Метан - химические свойства
Химические свойства метана ничем не отличаются от свойств, присущих всем веществам класса алканов. В школьном курсе химии метан изучают одним из первых веществ органики, так как он является одним из простейших представителей алканов.
Оглавление:
В его составе один атом углерода и четыре атома водорода.
Формула метана и способы его получения
| Молекулярная формула метана | Структурная формула метана |
|
СH4
|
Н
| Н — С — Н | Н |
Метан в больших количествах содержится в атмосфере. Мы не обращаем внимания на нахождение этого газа в воздухе, ведь на нашем организме это никак не отражается, а вот канарейки очень чувствительны к метану.
Когда-то они даже помогали шахтерам спускаться под землю. Когда процентное содержание метана изменялась, птицы переставали петь. Это служило сигналом для человека, что он спустился слишком глубоко и нужно подниматься наверх.

Образуется метан в результате распада остатков живых организмов. Не случайно с английского methane переводится, как болотный газ, ведь он может быть обнаружен в заболоченных водоемах и каменноугольных шахтах.
Основным источником газа в агропромышленном комплексе является рогатый скот. Да, метан они выводят из организма вместе с остальными продуктами жизнедеятельности. Кстати, увеличение числа рогатого скота на планете может привести к разрушению озонового слоя, ведь метан с кислородом образуют взрывоопасную смесь.
Метан в промышленности можно получить с помощью нагревания углерода и водорода или синтеза водяного газа, все реакции протекают в присутствии катализатора, чаще всего никеля.
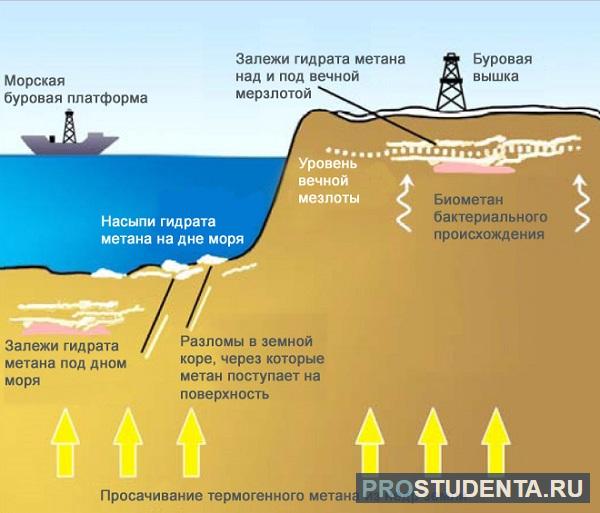
В США разработана целая система по добыче метана, она способна извлечь до 80% газа из природного угля. На сегодняшний день мировые запасы метана оцениваются экспертами в 260 триллионов метров кубических! Даже запасы природного газа значительно меньше.
В лаборатории метан получают путем взаимодействия карбида алюминия (неорганическое соединение алюминия с углеродом) и воды. Также с помощью гидроксида натрия, вступающего в реакцию с ацетатом натрия, более известного как пищевая добавка Е262.
Физические свойства метана
Характеристика:
- Бесцветный газ, без запаха.
- Взрывоопасен.
- Нерастворим в воде.
- Температура кипения: -162oC, замерзания: -183°C.
- Молярная масса: 16,044 г/моль.
- Плотность: 0,656 кг/м³.
Химические свойства метана
Говоря о химических свойствах, выделяют те реакции, в которые вступает метан. Ниже они приведены вместе с формулами.
Горение метана
Как все органические вещества, метан горит. Можно заметить, что при горении образуется голубоватое пламя.
СН4 + 2O2 → СO2↑ + 2Н2O
Называется такая реакция – реакцией горения или полного окисления.
Замещение
Метан также реагирует с галогенами. Это химические элементы 17 группы в периодической таблице Менделеева. К ним относятся: фтор, хлор, бром, йод и астат. Реакция с галогенами называется – реакцией замещения или галогенирования. Такая реакция проходит только в присутствии света.
Хлорирование и бромирование
Если в качестве галогена используется хлор, то реакция будет называться – реакцией хлорирования. Если в качестве галогена выступает бром, то – бромирование, и так далее.
CH4 + Cl2 → CH3Cl + НСl
CH4 + Br2 → CH3Br + НBr
Хлорирование. Низшие алканы могут прохлорировать полностью.
CH4 + Cl2 → CH3Cl + НСl
CH3Cl + Cl2 → CH2Сl2 + НСl
CH2Сl2+ Cl2 → CHCl3 + НСl
CHCl3 + Cl2 → CСl4 + НСl
Точно так же метан может полностью вступать в реакцию бромирования.
CH4 + Br2 → CH3Br + Н Br
CH3Br + Br2 → CH2Br2 + НBr
CH2Br2 + Br2 → CHBr3 + НBr
CHBr3 + Br2 → CBr4 + НBr
С йодом такой реакции уже нет, а с фтором наоборот сопровождается быстрым взрывом.
Разложение
Так же этому углеводороду свойственна реакция разложения. Полное разложение:
СН4 → С + 2H₂
И неполное разложение:
2СН4 → С2Н2 + 3Н2
Реакция с кислотами
Метан реагирует с концентрированной серной кислотой. Реакция носит название сульфирования и происходит при небольшом нагревании.
2СН4 + Н2SО4 → СН3SО3Н + Н2О
Окисление
Как уже было сказано, СH4 может полностью окисляться, но при недостатке кислорода возможно неполное окисление.
2СН4 + 3O2 → 2CO + 4Н2O
СН4 + О2 → С + 2Н2O
Помимо прочего для этого газа характерно каталитическое окисление. Оно происходит в присутствии катализатора. При разном соотношении моль вещества получаются разные конечные продукты реакции. В основном это:
- спирты: 2СН4 + O2 → 2СO3OН
- альдегиды: СН4 + O2 → НСОН + Н2O
- карбоновые кислоты: 2СН4 + 3O2 → 2НСОOН + 2Н2O
Реакция протекает при температуре 1500°C. Данная реакция также носит название – крекинг – термическое разложение.
Нитрование метана
Существует также реакция нитрования или реакция Коновалова, названная в честь ученого, который доказал, что с предельными углеводородами действует разбавленная азотная кислота. Продукты реакции получили название – нитросоединения.
CH4 + НNО3 → СН3NO2 + H2O
Реакция проводится при температуре 140-150°C.
Дегидрирование метана
Кроме того, для метана характерна реакция дегидрирования (разложения) – отцепление атомов водорода и получения ацетилена, в данном случае.
2CН4 → C2H2 + 3Н2
Применение метана
Метан, как и остальные предельные углеводороды, широко используется в повседневной жизни. Его применяют в производстве бензина, авиационного и дизельного топлива.
Используют в качестве базы для получения различного органического сырья на предприятиях. Также метан широко используется в медицине и косметологии.

Метан применяют для получения синтетического каучука, красок и шин.
Атлеты используют так называемый жидкий метан для быстрого набора массы за короткий промежуток времени.
А при хлорировании метана образуется вещество, которое в дальнейшем используется для обезжиривания поверхностей или как компонент в средствах для снятия лака. Некоторое время продукт взаимодействия метана и хлора использовали в качестве наркоза.


Ещё никто не комментировал эту статью. Оставьте комментарий первым!