Углерод - химические и физические свойства
Углерод – это, наверное, один из самых впечатляющих элементов химии на нашей планете, который обладает уникальной способностью образовывать огромное множество различных органических и неорганических связей.
Оглавление:
Одним словом, углеродные соединения, которые обладают уникальными характеристиками – основа жизни на нашей планете.
Что такое углерод

В химической таблице Д.И. Менделеева углерод находится под шестым номером, входит в 14 группу и носит обозначение «С».
Физические свойства
Это водородное соединение, входящее в группу биологических молекул, молярная масса и молекулярная масса которого – 12,011, температура плавления составляет 3550 градусов.
Степень окисления данного элемента может быть: +4, +3, +2, +1, 0, -1, -2, -3, -4, а плотность составляет 2,25 г/см3.
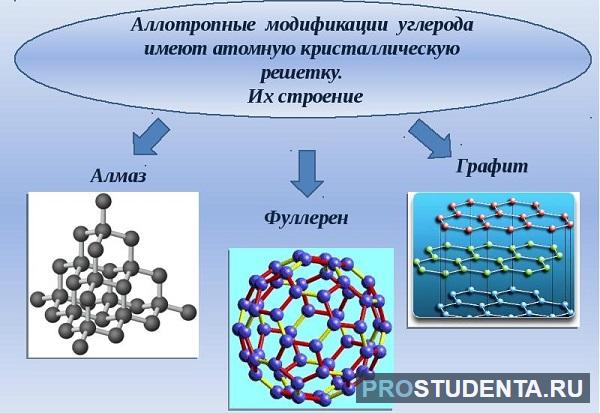
В агрегатном состоянии углерод - твердое вещество, а кристаллическая решетка - атомная.
Углерод имеет следующие аллотропные модификации:
- алмаз;
- графит;
- фуллерен;
- карбин.
Строение атома
Атом вещества имеет электронную конфигурацию вида - 1S22S22P2. На внешнем уровне у атома 4 электрона, находящиеся на двух разных орбиталях.

Если же брать возбужденное состояние элемента, то его конфигурация становится 1S22S12P3.
К тому же атом вещества может быть первичным, вторичным, третичным и четвертичным.
Химические свойства
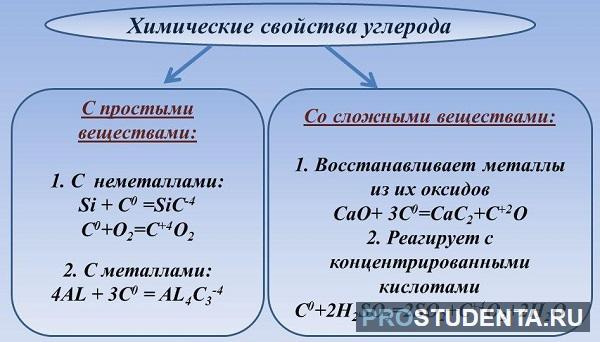
Пребывая в нормальных условиях, элемент инертен и во взаимодействие с металлами и неметаллами вступает при повышенных температурах:
- взаимодействует с металлами, вследствие чего образуются карбиды;
- вступает в реакцию с фтором (галоген);
- при повышенных температурах взаимодействует с водородом и серой;
- при повышении температуры обеспечивает восстановление металлов и неметаллов из оксидов;
- при 1000 градусах вступает во взаимодействие с водой;
- при повышении температуры горит.
Получение углерода
Углерод в природе можно найти в виде черного графита либо же, что очень редко, в виде алмаза. Ненатуральный графит получают с помощью реакции кокса с кремнеземом.

А ненатуральные алмазы получают, применяя тепло и давление вместе с катализаторами. Так металл расплавляется, а получившийся алмаз выходит в виде осадка.

Добавление азота приводит к получению желтоватых алмазов, а бора – голубоватых.
История открытия
Углерод использовался людьми с давних времен. Грекам был известен графит и уголь, а алмазы впервые нашлись в Индии. К слову, в качестве графита люди часто принимали схожие по виду соединения. Но даже несмотря на это, графит широко использовался для письма, ведь даже слово «графо» с греческого языка переводится как «пишу».

В настоящее время графит используется так же в письме, в частности его можно встретить в карандашах. В начале 18 века в Бразилии началась торговля алмазами, были открыты многие месторождения, а уже во второй половине 20 века люди научились получать ненатуральные драгоценные камни.
На настоящий момент ненатуральные алмазы используются в промышленности, а настоящие – в ювелирной сфере.
Роль углерода в организме человека
В тело человека углерод попадает вместе с пищей, в течение суток – 300 г. А общее количество вещества в человеческом организме составляет 21% от массы тела.
Из данного элемента состоят на 2/3 мышцы и 1/3 костей. А выводится из тела газ вместе с выдыхаемым воздухом либо же с мочевиной.
[warning]Стоит отметить: без этого вещества жизнь на Земле невозможна, ведь углерод составляет связи, помогающие организму бороться с губительным влиянием окружающего мира.[/warning]
Таким образом, элемент способен составлять продолжительные цепи либо же кольца атомов, которые представляют собой основу для множества других важных связей.
Нахождение в природе углерода
Элемент и его соединения можно встретить повсюду. В первую очередь отметим, что вещество составляет 0,032% от общего количества земной коры.

Одиночный элемент можно встретить в каменном угле. А кристаллический элемент находится в аллотропных модификациях. Также в воздухе постоянно растет количество углекислого газа.
Большую концентрацию элемента в окружающей среде можно встретить в качестве соединений с различными элементами. Например, двуокись углерода содержится в воздухе в количестве 0,03%. В таких минералах как известняк или же мрамор, содержатся карбонаты.
Все живые организмы несут в себе соединения углерода с иными элементами. К тому же остатки живых организмов становятся такими отложениями, как нефть, битум.
Применение углерода

Соединения этого элемента широко используются во всех сферах нашей жизни и перечислять их можно бесконечно долго, поэтому мы укажем несколько из них:
- графит используется в грифелях карандашей и изготовлении электродов;
- алмазы нашли свое широкое применение в ювелирной сфере и в буровом деле;
- углерод используют как восстановитель для выведения таких элементов, как железная руда и кремний;
- активированный уголь, состоящий в основном из этого элемента, широко используется в медицинской области, промышленности и в быту.


Ещё никто не комментировал эту статью. Оставьте комментарий первым!