Номенклатура, классификация и свойства карбоновых кислот
 Органические соединения, называемые карбоновыми кислотами, — класс органических соединений, в составе молекул которых содержатся карбоксильные группы, -COOH, одна или несколько. Лёгкое отщепление протона карбоксильной группы обуславливает кислые свойства таких соединений.
Органические соединения, называемые карбоновыми кислотами, — класс органических соединений, в составе молекул которых содержатся карбоксильные группы, -COOH, одна или несколько. Лёгкое отщепление протона карбоксильной группы обуславливает кислые свойства таких соединений.
Оглавление:
Номенклатура и строение органических соединений
Название в номенклатуре ИЮПАК строится из названия углеводорода, соответствующего углеродной цепочке, содержащей функциональную группу, с окончанием «овая» и добавлением слова «кислота». Атом углерода в составе карбоксильной группы считается первым в углеводородной цепочке. Например, для формулы СН3-СН2-COOH название вещества — пропановая кислота, а СН3-С(СН3)-СООН — 2-метилпропановая, CH3CH2CH2COOH — бутановая.
Рациональная номенклатура к названию углеводорода требует добавления окончания «карбоновая» и слова «кислота», причём атом углерода карбоксила в нумерацию не включается. Например, этилкарбоновая кислота — СН3-СН2-СООН.
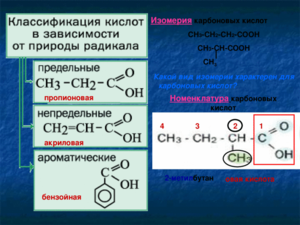 У многих веществ гомологического ряда кислот есть тривиальные названия. Например, уксусная (СН3-СООН), муравьиная (НСООН), валериановая (С4Н8-СООН), маргариновая (С16Н33-СООН) и многие другие.
У многих веществ гомологического ряда кислот есть тривиальные названия. Например, уксусная (СН3-СООН), муравьиная (НСООН), валериановая (С4Н8-СООН), маргариновая (С16Н33-СООН) и многие другие.
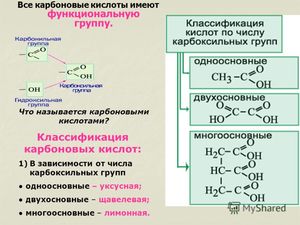
Функциональная группа COOH состоит из карбонила — CO и гидроксила — OH, тем не менее свойства кислот отличаются от свойств альдегидов и спиртов, содержащих в своём составе эти группы.
Общая формула предельных одноосновных карбоновых кислот^ R-COOH, где R — углеводородный радикал.
Классификация карбоновых кислот
Молекулы, содержащие одну функциональную группу, будут называться одноосновными (монокарбоновыми), содержащие две и более — ди- и многоосновными (соответственно ди- и поликарбоновыми).
В зависимости от того, с каким радикалом связан карбоксил, кислоты разделяют на следующие:
- ареновые;
- алифатические;
- алициклические;
- гетероциклические.
По насыщенности углеводородного радикала разделяют насыщенные (предельные, алкановые) и ненасыщенные (непредельные).
При других функциональных группах кислоты будут называться гетерофункциональными, например, аминокислоты, нитрокислоты и т. д.
Качественные реакции
Самые основные качественные реакции органической химии:
- окраска индикатора — красное окрашивание лакмуса;
- реакция с карбонатами или гидрокарбонатами, например, с содой — выделение СО2;
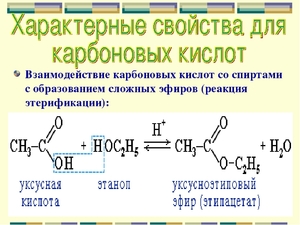
- реакция этерификации — характерный запах продукта реакции (эфира).
Физические свойства
С увеличением массы молекулы уменьшается плотность и растворимость в воде, температура кипения же, напротив, увеличивается. Так, низшие, например, уксусная и муравьиная кислоты являются растворимыми в воде жидкостями, а высшие карбоновые кислоты, такие как пеларгоновая, стеариновая, пальмитиновая и другие — твёрдые вещества, которые в воде не растворяются.
 Молекулы монокарбоновых кислот образуют довольно прочные водородные связи. В твёрдом и жидком состояниях они находятся в виде циклических димеров, а в водных растворах — в виде линейных.
Молекулы монокарбоновых кислот образуют довольно прочные водородные связи. В твёрдом и жидком состояниях они находятся в виде циклических димеров, а в водных растворах — в виде линейных.
Интересная закономерность наблюдается в изменении температур плавления кислот нормального строения. Кислоты, количество атомов углерода в радикале, которых чётное, кипят при более высоких температурах, чем имеющие нечётное. Объясняется это симметричностью строения молекул с чётным количеством углеродных атомов и, как следствие, более сильным взаимодействием между молекулами, а значит большей прочностью кристаллической решётки вещества. Молекулы же нечётного ряда взаимодействуют слабее, соответственно, разрушить их взаимодействие при нагревании проще.
Химические свойства
Таблица основных свойств карбоновых кислот.
| Кислотные свойства | |
| Характерные кислотные свойства проявляются в реакциях с металлами, гидроксидами и основными оксидами, а также при вытеснении кислоты (более слабой) из соли. | 2CH3COOH + Mg ⟶ (CH3COO)2Mg + H2 CH3COOH + koh ⟶ CH3COO К + H2O CH3COOH + NH4OH ⟶ CH3COONH4 + H2O 2CH3COOH + CaO ⟶ (CH3COO)2C a + H2O 2CH3COOH + Na2SiO3 ⟶ H2SiO3 + 2CH3COONa |
| Диссоциация | |
| В водных растворах поведение монокарбоновых аналогично поведению одноосновных: происходит ионизация молекулы с образованием иона водорода и карбоксилат иона. | RCOOH ⟶ RCOO - + Н+ |
| Восстановление | |
| Восстановление до спирта происходит при помощи литийалюминийгидрида ( LiAlH4), а также при кипячении в тетрагидрофуране. Плюсом восстановления в диборане (B2H4) является то, что процесс идёт в более мягких условиях и восстановление других функциональных групп не происходит (NO2, COOR и СN). | CH3(CH2)4COOH + H2 → CH3(CH2)4CH2OH + H2O |
| Окисление | |
| В атмосфере кислорода происходит окисление с выделением углекислого газа и воды. | CH3COOH + 2O2 ⟶ 2СO2 + 2H2O |
| Декарбоксилирование | |
Насыщенные одноосновные огранические соединения сложно подвергаются декарбоксилированию даже при нагревании из-за прочности связи углерод-углерод:
|
|
| Реакция этерификации | |
| Нагревание в присутствии H2SO4 спирта и карбоновой кислоты приводит к сложным эфирам | CH3COOH + CH3CH2OH ⟶ CH3COOCH2CH3 + H2O |
| Образование производных | |
Замещение гидроксильной группы другой функциональной группой (Х) приводит к образованию веществ с общей формулой RCO - X . Это могут быть, например:
|
|
| Получение ангидридов | |
| Производные общей формулой R-C(O)-O-C(O)-R получают межмолекулярной дегидратацией карбоновых органических соединений. Реакция проходит в присутствии водоотнимающего агента (P2O5). | CH3COOH + CH3COOH ⟶ CH3 -C(O)-O-C(O)- CH3 |
| Галогенирование | |
| Взаимодействие с галогенами на свету приводит к образованию галогензамещённых (α-галогенкарбоновых) кислот. | C2H5COOH + Br2 ⟶ CH3CH(Br)COOH + HBr или CH3COOH + 3Cl2 ⟶ C(Cl)3COOH + 3HCl |
Карбоновые считаются слабыми кислотами. При этом монокарбоновые слабее ди- и трикарбоновых кислот. Заместители, являющиеся донорами электронов, ослабляют кислотные свойства, а электроноакцепторные заместители их усиливают, как и кратные связи. Чем дальше заместитель от карбоксильной группы, тем слабее его влияние.
К важным свойствам таких производных, как соли относится реакция получения кетонов методом пиролиза. Кальциевые, ториевые или бариевые соли при нагревании до температуры около 300 °С превращаются в кетоны.
Способы получения
В лаборатории можно получить:
 окислением: альдегидов R-COH + [O] → R-COOH, спиртов R-CH2-OH + 2[O] → R-COOH + H2O, алкенов;
окислением: альдегидов R-COH + [O] → R-COOH, спиртов R-CH2-OH + 2[O] → R-COOH + H2O, алкенов;- деструкцией алкенов;
- гидролизом сложных эфиров R-COOR1 + H2O → R-COOH + R1-COOH, галогенпроизводных R-COCl + NaOH → 2R-COOH + NaCl, амидов, нитрилов, тригалогеналканов;
- декарбоксилированием;
- из солей R-COONa + HCl → R-COOH + NaCl;
- растворением ангидридов (R-CO)2O + H2O → 2R-COOH.
Промышленные способы синтеза основаны на окислении углеводородов с длинными углеводородными цепями. Процесс многоступенчатый с множеством побочных продуктов.
Окисление алкенов: 2CH3-CH2-CH2-CH3 + 5O2 → 4CH3COOH + 2H2O.
Окисление алкенов: CH2=CH2 + O2 → CH3COOHСH3-CH=CH2 + 4[O] → CH3COOH + HCOOH.
Некоторые кислоты (такие как муравьиная, масляная, уксусная, валериановая и прочие) получаются специфическими способами с использованием природных ингредиентов (жиров, эфирных масел, восков).
Применение карбоновых кислот
Применяют кислоты в химической промышленности в качестве исходных соединений для органического синтеза, например, галогенкислот, кетонов, виниловых эфиров.
Области применения муравьиной кислоты основаны на её бактерицидных свойствах. Она применяется в качестве антисептика, в пищевой промышленности, а так же сельском хозяйстве как консервант.
В пищевой, химической, фармацевтической промышленности, а также в домашнем хозяйстве активно применяется уксусная.
 Масляная кислота в химической промышленности используется в качестве вещества, из которого производят ароматизаторы, пластификаторы, с её помощью экстрагируют щелочно-земельные металлы.
Масляная кислота в химической промышленности используется в качестве вещества, из которого производят ароматизаторы, пластификаторы, с её помощью экстрагируют щелочно-земельные металлы.
Щавелевая может применяться в качестве реагента в аналитической химии органических веществ, в металлургической промышленности, для приготовления чернил.
Стеариновая C17H35COOH, пальмитиновая C15H31COOH используются как компонент косметических средств, в качестве смазочного материала при обработке металлов. Их натриевая соль является поверхностно активным веществом.


Ещё никто не комментировал эту статью. Оставьте комментарий первым!