Применение и получение аммиака, физические свойства газа
 Аммиак — это химическое соединение водорода и азота, имеющее структурную (электронную) формулу NH3. Этот газ не имеет цвета, отличается чрезвычайно едким, специфическим запахом. Вещество является важнейшим продуктом химического производства, каждый год количество вырабатываемого нитрида водорода достигает 180 млн тонн.
Аммиак — это химическое соединение водорода и азота, имеющее структурную (электронную) формулу NH3. Этот газ не имеет цвета, отличается чрезвычайно едким, специфическим запахом. Вещество является важнейшим продуктом химического производства, каждый год количество вырабатываемого нитрида водорода достигает 180 млн тонн.
Оглавление:
 Аммиак — это химическое соединение водорода и азота, имеющее структурную (электронную) формулу NH3. Этот газ не имеет цвета, отличается чрезвычайно едким, специфическим запахом. Вещество является важнейшим продуктом химического производства, каждый год количество вырабатываемого нитрида водорода достигает 180 млн тонн.
Аммиак — это химическое соединение водорода и азота, имеющее структурную (электронную) формулу NH3. Этот газ не имеет цвета, отличается чрезвычайно едким, специфическим запахом. Вещество является важнейшим продуктом химического производства, каждый год количество вырабатываемого нитрида водорода достигает 180 млн тонн.
Характеристика и физические свойства газа
 Многие путают аммиак и нашатырный спирт, но эти вещества имеют качественное отличие в изначальном состоянии. Первый — это бесцветный газ, переходящий в жидкость при температуре ниже -33 °C, второй — это раствор. Они также различаются и сферой применения. Аммиак чаще используют в промышленности, нашатырный спирт — в медицине и быту.
Многие путают аммиак и нашатырный спирт, но эти вещества имеют качественное отличие в изначальном состоянии. Первый — это бесцветный газ, переходящий в жидкость при температуре ниже -33 °C, второй — это раствор. Они также различаются и сферой применения. Аммиак чаще используют в промышленности, нашатырный спирт — в медицине и быту.
Связь молекул нитрида водорода содержит треугольную пирамиду, вершиной которой является атом азота. Благодаря своей специфической структуре и высокой полярности аммиак быстро растворяется в воде. Его плотность равняется 0.7723 г/см³. Этот газ более лёгкий, чем воздух. Молярная масса аммиака составляет 17 г/моль, у второго — 29 г/моль.
Вещество легко трансформируется в бесцветную жидкость, которая сильно преломляет солнечные лучи. В больших дозах вещество очень токсично, но при малых оказывает возбуждающее и раздражающее воздействие.
Есть множество сфер, где используется аммиак.
- Газ применяется как удобрение, из него формируют азотную кислоту и соду. Обработанные бутоны начинают ярко благоухать. Пары аммиака изменяют оттенки самих цветов.
- Используется как основа для образования спирта (раствор аммиака), который применяется в, косметологии, а также в качестве удобрения.
- При наружном использовании вещество улучшает восстановление клеток и расширяет сосуды. Оно снижает напряжение мышечных волокон и убирает спазмы, подавляя очаги нервного возбуждения. Небольшие дозы стимулируют достаточную секрецию желёз.
- Аммиак используется в качестве хладагента (вещества, отнимающего тепло) в промышленных или бытовых организациях.
- Этот бесцветный газ эффективен при строительстве, изготовлении взрывчатки.
 Своё название вещество получило от оазиса Аммона, который находится в Северной Африке. Аммиак является продуктом разложения мочевины, которая очень быстро отдаёт составные компоненты в жаркой среде. По другой версии, происхождение термина можно совместить с ритуалом древних египтян в честь бога Амона, в котором нужно было нюхать нашатырь.
Своё название вещество получило от оазиса Аммона, который находится в Северной Африке. Аммиак является продуктом разложения мочевины, которая очень быстро отдаёт составные компоненты в жаркой среде. По другой версии, происхождение термина можно совместить с ритуалом древних египтян в честь бога Амона, в котором нужно было нюхать нашатырь.
Наблюдает сильный прирост в потребности этого вещества. Сегодня он на 30 млн тонн выше, чем 30 лет назад. На лидирующие позиции по добыче аммиака вышла Россия.
Транспортировка производится при помощи специальных цистерн, которые изготавливаются из надёжного сплава, так как аммиак способен расщеплять множество металлов. Перевозчикам необходимо отрегулировать температуру и давление в ёмкости. Поэтому при покупке этого газа приходится задумываться о приобретении специализированного прицепа.
Влияние вещества на организм
 Аммиак оказывает очень сильное воздействие на человеческий организм. Некоторые люди смутно представляют, какой опасности могут подвергнуться, если станут применять вещество бездумно. Этот бесцветный газ относят к 4 разряду экологической опасности. Предельно допустимая концентрация (ПДК) в атмосфере колеблется в границах 20 мг/м3.
Аммиак оказывает очень сильное воздействие на человеческий организм. Некоторые люди смутно представляют, какой опасности могут подвергнуться, если станут применять вещество бездумно. Этот бесцветный газ относят к 4 разряду экологической опасности. Предельно допустимая концентрация (ПДК) в атмосфере колеблется в границах 20 мг/м3.
При скоплениях, не превышающих нормы ПДК в 20 мг/м³, человек не ощущает резкого запаха аммиака в атмосфере. При 37 мг/м³ обоняние фиксирует пары ядовитого токсина. Если запах газа ощущается, значит, допустимая норма превышена.
- Аммиак оказывает тяжёлый удушающий и нейротропный (поражающий нервные клетки) эффект. Ингаляционное отравление приводит к глобальному отеку лёгких и дисфункции многих систем.
- Токсичность газа негативно сказывается на коже, слизистых и дыхании. Человек, находящийся в зоне поражения, испытывает першение в горле, сильный приступ кашля, максимальную затруднённость дыхания, а также боль в глазах и слезотечение. При предельных концентрациях возможен отёк лёгких.
- Отравление аммиачными парами вызывает глухоту, рвоту, тяжёлые головные боли и сильное головокружение. Могут наблюдаться отклонения в поведении, маниакальное возбуждение и бред. Эти симптому имеют особенность повторяться через некоторое время, если не провести соответствующей терапии. Особо важно не допускать превышения максимума этого токсина в помещениях.
Продолжительное действие вещества на организм влечёт некробиотические (омертвение клеток) или воспалительные процессы. Нашатырный спирт обладает качествами токсина, его неправильное применение провоцирует остановку дыхания. Перед использованием следует внимательно прочесть инструкцию или пройти консультацию со специалистом. При попадании вещества на слизистую или роговицу глаза поражённые участки промывают достаточным количеством воды.
Получение аммиака и его производных
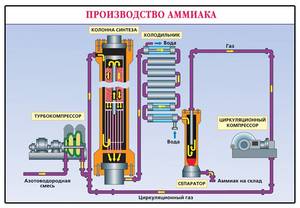 В промышленности вещество добывают во время реакции взаимодействия между водородом (H) и азотом (N2). Процесс получения (синтеза) разработал немецкий физик по фамилии Габер. Эта реакция стимулирует выделение тепла и снижение количества объёма.
В промышленности вещество добывают во время реакции взаимодействия между водородом (H) и азотом (N2). Процесс получения (синтеза) разработал немецкий физик по фамилии Габер. Эта реакция стимулирует выделение тепла и снижение количества объёма.
Чтобы достичь лучших результатов, необходимо извлекать аммиак при достаточно низких температурах и предельном давлении. Для получения этого газа в лабораториях применяют воздействие тяжёлых щелочей на соли аммония. При сгорании учитывается его высокая термическая сопротивляемость, поэтому при реакции поддерживают достаточное количество кислорода.
- Равновесное состояние достигается при помощи катализатора Fe с примесями оксидами алюминия и калия. Выход газа при температуре 500 °C и давлении 350 атм. Составляет 30%.
- Собирание вещества производится методом вытеснения воздуха из колбы, укреплённой дном кверху.
- Каталитическое окисление аммиака приводит к образованию оксида азота (NO) и воды (H2O). Такая реакция призвана сократить потери энергии при получении вещества.
- NH3 степень окисления атомов азота равняется 3. Эта вспомогательная величина облегчает учёт переноса электронов.
- Чтобы получить азоимид (H3N), бесцветную и взрывоопасную кислоту, используют воздействие NaN3 на NaNH2. Вещество чрезвычайно токсично и сходно с цианидами.
- В промышленности используют азотистую кислоту, имеющую формулу HNO3. Она применяется в производстве удобрений, красителей, лекарств, а также в военном деле.
- При горении, реакции с кислородом (O2), аммиак образует азот и обыкновенную воду, температура его кипения составляет — 33,4 °С.
- При взаимодействии оксида меди (CuO) и аммиака начинается выделение металла, азота и воды.
- Диссоциация аммиачного раствора происходит при нагревании до 600 — 650 °C. В процессе обязательно участвует специфический катализатор. Чтобы рассчитать константу диссоциации, используют химическое уравнение.
Вещество повседневно используется в химической промышленности и медицине. Оно относится к 4-му классу опасности, поэтому требует соблюдения максимальных мер предосторожности при работе с ним.


Ещё никто не комментировал эту статью. Оставьте комментарий первым!