Циклоалканы: общая формула, свойства и применение
Насыщенные углеводы с циклическим замкнутым углеродным скелетом принято называть циклоалканами. В научной среде встречаются и другие названия — циклопарафины, нафтены, цикланы. Строение, свойства и способ получения этих органических насыщенных соединений отличается от обычных алканов, которые обладают аналогичным количеством углеродных атомов. Общую формулу циклоалканов изучают на уроках химии в 10 классе.
Оглавление:
Краткое описание
Проведённые лабораторные исследования показали, что циклоалканы обладают таким же строением, как и алканы. Все вещества пребывают в состоянии sp3-гибридизации. Это значит, что атомы углерода заняты водородом. К категории простейших веществ относится циклопропан с тремя атомами углерода. В итоге формируется треугольный цикл.
Во время химической реакции может увеличиваться количество атомов углерода. По этой причине форма цикла меняется, усложняется. Например, если молекула содержит сразу 5 атомов углерода, тогда она будет иметь вид пятиугольника. Для корректного изображения должна быть задействована геометрическая фигура, во всех углах которой по умолчанию находятся группы СН2.
Если следовать правилам номенклатуры ИЮПАК, основное описание цикланов будет составляться из приставки «цикло», а также научного названия органического насыщенного соединения. Именно циклопропан образует основной гомологический ряд циклоалканов (общая формула — CnH2n). Например:
- циклобутан — С4Н8;
- циклопропан — С3Н6;
- циклопентан — С5Н10;
- циклооктан — С8Н16;
- циклононан — C9H18;
- циклогексан — С6Н12;
- циклогептан — С7Н14;
- циклоундекан — С11Н22;
- циклононан — С9Н18;
- циклодекан — С10Н20;
- циклододекан — С12Н24.
Среди основных отличий циклоалканов от алканов можно выделить наличие у последних двух дополнительных атомов водорода. Например, циклопентан — С5Н10, пентан — С5Н12. Из полезных ископаемых (газа и нефти) можно получить нафтены. Дополнительно может быть задействовано гидрирование ароматических аренов (углеводородов), дегидрирование алканов. Эти химические реакции можно записать так: С6Н14 ↔ C6H12 + Н2, C6H6 + 3H2 → C6H12. Углеродная пространственная и межклассовая изомерия с алкенами образуется благодаря CnH2n. Исключений не предусмотрено.
Принцип строения
В пределах циклоалкана все углеродные атомы связаны между собой. Устойчивость циклопарафинов существенно возрастает после увеличения общего количества атомов углерода, которые образуют обычные (С5-С7), а также малые (С3-С4) циклы. В последнем случае речь касается С3Н6:
- Для молекулы циклопропана свойственен плоский цикл, который возникает только благодаря 3 атомам углерода. А вот водород занимает энергетически невыгодное положение, что влияет на увеличение «напряжённости» и приводит к общей неустойчивости.
- В плоском равностороннем треугольнике валентные углы находятся в пределах 60°. В молекулах циклопропана гибридизованные орбитали атомов углерода вне прямой линии, которая соединяет ядра атомов, пересекаются между собой.
А вот для молекул С6Н12 не характерно плоское строение, из-за чего доступны некоторые конформации. Если рассматривать характеристики с энергетической стороны, наиболее выгодными являются конформации «ванны» и «кресла». Повышению устойчивости обычных циклов способствует тетраэдрическое расположение связей вблизи атомов углерода.
Доступно замещение, но невозможна реакция присоединения. Наименьшим циклоалкеном является циклопропен. C8H16 — общая формула CnH2n, следовательно, это алкен — углеводород с одной двойной связью.
Способы получения
В большом количестве циклоалканы содержатся в нефти. Благодаря этому и было получено одно из названий — нафтены. В процессе переработки нефтяных продуктов выделяются востребованные в промышленности циклоалканы С5-С7. С6Н12 и его алкильные производные можно получить только в результате гидрирования бензола, а также его гомологов, которые являются продуктами нефтепереработки.
Не менее важным способом получения CnH2n является реакция дегидроциклизации алканов. В лабораторных условиях большой спрос получила циклизация дигалогеналканов. Но у таких химических реакций есть свои нюансы. Принцип взаимодействия активных металлов с дигалогензамещенными алканами основан на том, что в итоге образуются различные циклоалканы. Металлургический натрий можно заменить порошкообразным цинком.
Принцип строения образующегося CnH2n определяется структурой задействованного дигалогеналкана. При правильном подходе можно получить циклоалканы определённого строения. Например, если в результате химической реакции должен получиться 1,3-диметилциклопентан, тогда следует использовать 4-диметилпентан и 1,5-дигалоген.
Основные химические свойства
Циклоалканы активно используются в различных отраслях современной промышленности. Их химические свойства во многом зависят от размера цикла, влияющего на итоговую устойчивость органического насыщенного соединения. В циклопропане и циклобутане валентные углы существенно меньше стандартного значения (109°28'), что свойственно sp3-гибридизованному атому имеющегося углерода. Для этой ситуации свойственно большое напряжение циклов и их общее стремление к раскрытию под действием реагентов.
Циклобутан и циклопропан, а также все их производные могут вступать в реакцию присоединения. В этом случае сложные соединения проявляют свойства ненасыщенных соединений. Наибольшей устойчивостью обладают 6-членные циклы, так как в них отсутствует угловое напряжение.
Среди основных химических свойств циклоалканов можно выделить:
- Галогенирование. Циклобутан и циклопропан могут присоединять галогены. Начиная с С5Н10 нафтены вступают в реакцию замещения с элементами химической таблицы Менделеева, находящимися в семнадцатой группе. Например, C3H6 + Br2 → BrCH2-CH2-CH2Br, C6H12 + Cl2 → C6H11Cl + HCl.
- Присоединение галогеноводородов. Циклобутан и циклопропан способны присоединять соединения, образованные из водорода и галогенов (элементов подгруппы фтора). Химическую реакцию можно изобразить следующим образом: C3H6 + HI → CH3-CH2-CH2I.
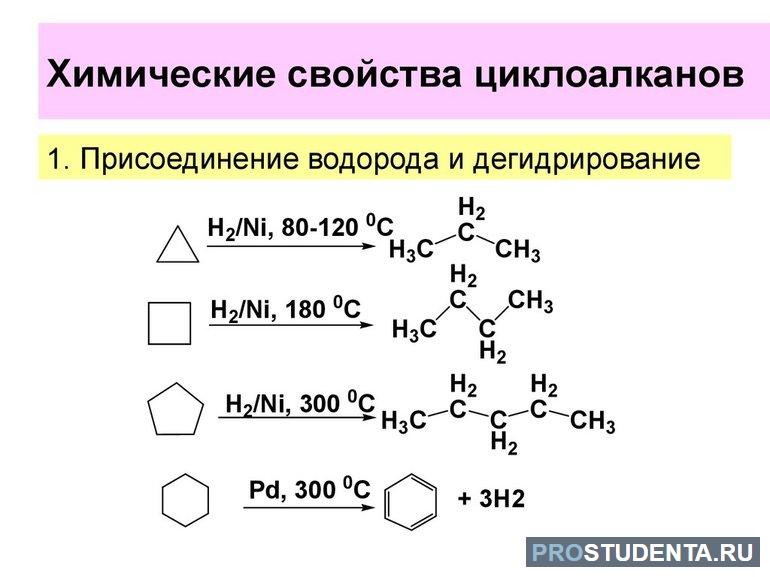
- Гидрирование. С3Н6 и С4Н8 в результате химической реакции под воздействием высоких температур в присутствии никеля присоединяют водород. Например, C4H8 + H2 → CH3-CH2-CH2-CH3.
- Окисление. Эта химическая реакция возможна только при условии присутствия катализатора: C6H12 + 2O2 ↔ C6H10O4.
- Дегидрирование. Все нафтены от С5Н10 и выше дегидрируются. Но для этой химической реакции должен присутствовать катализатор. В качестве примера можно рассмотреть структурную формулу: C6H12 ↔ C6H6 + 3H2.
Для синтеза кетонов, спиртов, полимеров и кислот применяются нафтены. Полученные в итоге вещества используются в качестве растворителей.
Физические характеристики
Основные физические свойства CnH2n практически не отличаются от линейных алканов, которые обладают аналогичным количеством атомов в молекулах. Изучаемые на уроках химии циклобутан и циклопропан представляют собой газы, циклогексан и циклопентан — жидкости, которые являются неотъемлемыми компонентами некоторых продуктов нефтедобывающей промышленности. Высшие циклоалканы относятся к категории твёрдых веществ.
Температура плавления и кипения циклоалканов гораздо выше, чем у алканов. Это можно объяснить более выраженным межмолекулярным взаимодействием циклических структур. Нафтены практически не растворяются в воде, из-за чего должны быть задействованы органические растворители. Циклопропан закипает при -126.9 °C, плавится при -33 °C. Циклогексан кипит при +6.5 °C, а циклобутан — при -80 °C. Химические свойства CnH2n получили большой спрос в разных отраслях промышленности.
Сферы применения
Циклопарафины известны своим обезболивающим эффектом, а также безопасностью для человека (при умеренном использовании), благодаря чему эти насыщенные органические вещества применяются в медицинской отрасли в качестве наркоза. Но высокие показатели огнеопасности накладывают на них определённые ограничения.
Циклопропан входит в состав востребованных природных инсектицидов — пиретринов, которые являются производными хризантемовой кислоты. Особенностью этих средств является то, что они используются для борьбы с различными насекомыми, но абсолютно безопасны для теплокровных животных и людей.
Более востребованными аналогами пиретринов являются пиретроиды, которые синтезированы и используются в различных отраслях. Доля этих веществ на мировом рынке инсектицидов достигает 30%.
В некоторых месторождениях нефти содержится циклопентан. Кольцо С5Н10 входит в состав многих физиологически активных природных соединений. Например, стероиды, простагландины, терпеноиды, терпены, а также их синтетические аналоги, которые активно используются в медицине.
Самым востребованным среди циклоалканов является С6Н12. Это вещество используется в качестве сырья при производстве адипиновой кислоты, которая необходима для получения нейлона (синтетического волокна). Циклогексан применяется в сфере производства капролактама, без которого невозможно изготовление капрона.
Во время промышленной ароматизации нефтепродуктов циклогексан, а также его гомологи постепенно превращаются в толуол, бензол и другие распространённые углеводороды. При их использовании происходит органический синтез красителей и медицинских препаратов. В структуру многих природных соединений входят циклогексановые кольца. Некоторые их аналоги получаются только синтетическим путём, чтобы в дальнейшем использовать в медицине. К примеру, фармацевты изготовляют ментол, который обладает отличными успокаивающими и антисептическими свойствами.








Ещё никто не комментировал эту статью. Оставьте комментарий первым!