История открытия и формулировка периодического закона Менделеева
Дмитрий Иванович Менделеев — выдающийся российский ученый, открывший фундаментальный закон в химии. Его открытие датируется 1869 годом. Химик структурировал все известные на тот период элементы в единую таблицу. В первоначальном варианте периодический закон Менделеева опирался на атомные массы. Но со временем стало понятно, что периодичность повторения свойств химических элементов связана с величиной заряда атома и электронной конфигурацией.
Оглавление:
История открытия кратко
Попытки создать систему, объясняющую свойства химических элементов, предпринимались и ранее. Первым вступил на эту стезю немецкий химик Деберейнер, объединивший элементы в три группы — триады. Затем была «Земная спираль» Александра де Шанкуртуа, октавы Ньюлендса и таблицы Одлинга и Мейера.
Работа Менделеева началась с его желания написать понятное и подробное пособие по химии для студентов. Так он начал писать книгу, где описывал свойства всех элементов и их соединений. Работа заняла 15 лет. Изучая тему, Дмитрий Иванович заметил такую закономерность, если атомы расположить в порядке возрастания массы, то через каждые семь элементов их свойства сходятся.
На основании этого наблюдения ученый сформулировал свой закон. Он звучал так: свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов. Датой открытия считается 1 марта 1869 года.
Открытый закон Менделеева не сразу был принят в научных кругах. Но работа Дмитрия Ивановича позволила предсказать существование неизвестных на тот момент атомов. Когда эти элементы были действительно открыты, периодический закон признали важной теоретической основой химии.
Позднее стало известно, что свойства атомов зависят не от их массы, а от строения и величины ядра. В современном прочтении формулировка периодического закона Менделеева звучит так:
«Свойства элементов, форма и свойства образованных ими соединений находятся в периодической зависимости от величины заряда ядер их атомов»
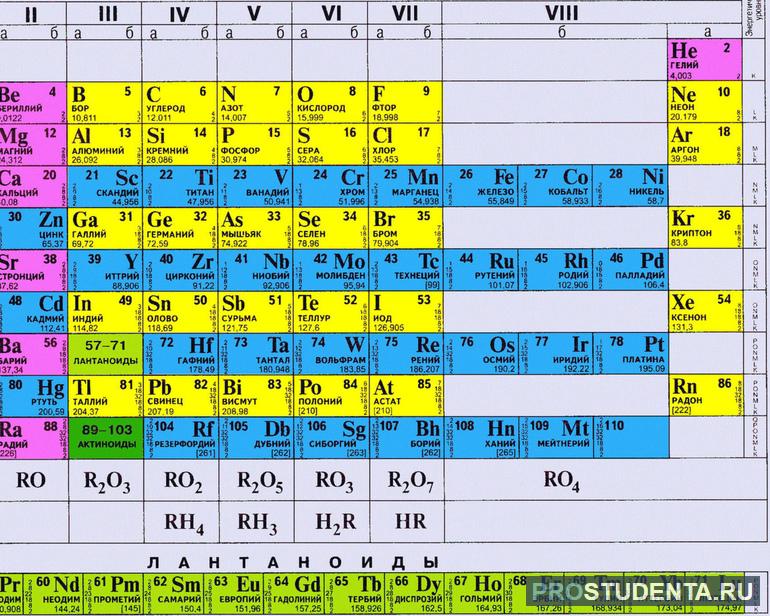
Структура системы
Все химические свойства элементов и их соединений базируются на правиле октета. Оно гласит, что каждый атом стремится завершить свой внешний уровень, набрав на нем 8 электронов. Для этого элементу нужно или забрать недостающие, или отдать лишние. Исходя из этого проявляются кислотные, основные или амфотерные свойства.
То, насколько активно элемент проявляет свои признаки, зависит от нескольких показателей:
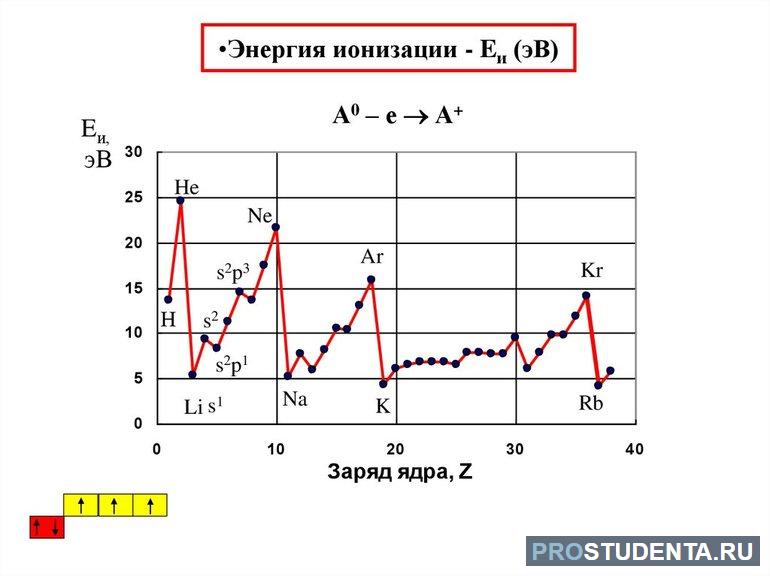
- Энергия ионизации — количество энергии, которое нужно затратить атому для того, чтобы отдать свой электрон. Чем это значение больше, тем сложнее это сделать.
- Электроотрицательность — сила, с которой ядро притягивает к себе отрицательные частицы.
- Сродство к электрону — мера изменения энергии после приобретения дополнительного отрицательного заряда.
По этим показателям элементы делятся на металлы и неметаллы. Первой группе проще отдать свои электроны и перейти в положительно заряженный ион. Вторые атомы проявляют окислительные свойства, становясь отрицательными.
Если в таблице провести диагональ от бора к Ga, то оказавшиеся ниже элементы относятся к металлам, а выше — неметаллам. Атомы, попавшие на диагональ, называются переходными и проявляют оба типа свойств.
Значение группы
Группа — вертикальный ряд в таблице, всего их насчитывается восемь. Каждый столбец делится на две подгруппы: главную и побочную. Атомы одной группы имеют сходные электронные конфигурации и одинаковое число электронов на внешнем уровне. Это число такое, каков номер соответствующей группы. У элементов главной подгруппы электроны расположены на s и р уровнях, а у расположенных в побочных подгруппах валентные электроны занимают внешний s-уровень и внутренние d и f.
Таким образом, в первой группе располагаются щелочные металлы с одним электроном на внешнем уровне. Во второй группе элементы имеют уже два электрона, в третьей — три и так далее. В восьмой группе расположены атомы с завершенным внешним слоем, их называют инертными или благородными газами. Это гелий, аргон, ксенон и так далее. Они не вступают ни в какие химические реакции и не имеют цвета и запаха.
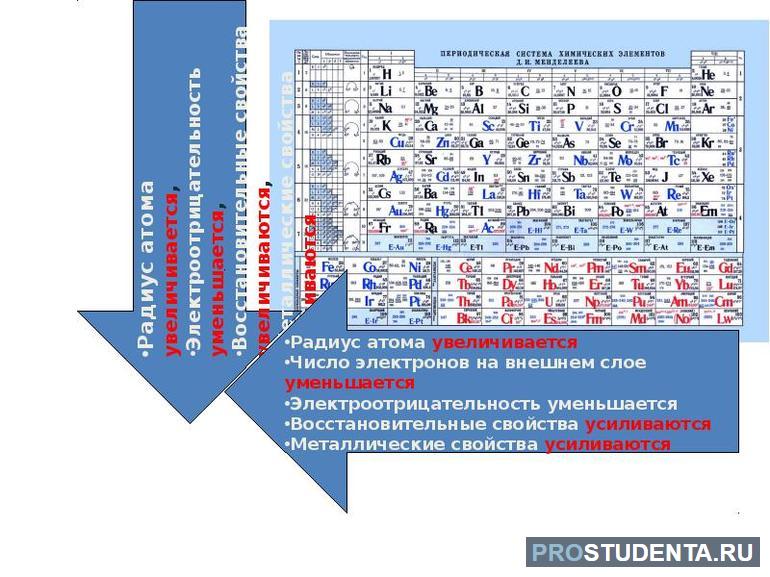
Изменение свойств при продвижении по группе снизу вверх такое:
- атомный радиус возрастает;
- металлические свойства усиливаются;
- неметаллические ослабевают;
- падает значение электроотрицательности;
- гидроксиды и бескислородные кислоты становятся сильнее.
Валентность атомов равняется номеру группы. Исключением является азот, кислород, фтор и благородные газы. Общая формула высших оксидов одинаковая для элементов одной группы, это относится и к гидратам. А формула водородных соединение совпадает только для атомов одной группы главной подгруппы.
Суть периода
Период — это горизонтальный ряд в таблице Менделеева. Все они, кроме I, начинаются со щелочного металла и заканчиваются инертным газом. Первый период самый маленький и содержит только два атома: водород и гелий. Номер периода показывает общее количество электронных слоев. Так, у водорода только один уровень, у азота — два и так далее.
Несмотря на общее число слоев, значение радиуса у атомов одного периода неодинаковое. Это связано с тем, что при движении от I группы к VII возрастает число электронов на внешнем слое. Из-за электростатических сил притяжения между ними и ядром атомный радиус немного сжимается. С ростом номера периода:
- уменьшается атомный радиус;
- ослабевают металлические свойства, а металлические наоборот;
- возрастает электроотрицательность.
Свойства оксидов начинаются основными, затем идут амфотерные и заканчиваются кислотными. Валентность атомов в кислородных соединениях с ростом периода возрастает.
Работа с таблицей
Каждый атом имеет точное положение в таблице Менделеева. Этим ячейкам присвоен свой уникальный номер. Это число показывает количество протонов в ядре атома. При необходимости число нейронов вычисляется как разница между атомной массой и номером. Масса элементов в таблице указана средняя между всеми существующими изотопами для конкретного случая.
На примере углерода: С расположен в IV группе, главной подгруппе, во II периоде. Его номер 6. Значит, атом углерода имеет два энергетических уровня, на которых вращаются шесть электронов. Четыре из них расположены на внешнем слое и два — на первом. Высшая валентность углерода равняется IV. В ядре находится 6 протонов.
Открытие периодического закона Менделеевым имело огромное значение для развития химии. Он впервые позволил систематизировать все известные элементы, а также объяснить их свойства. Более того, зная общий принцип работы закона, ученые сумели предсказать и открыть множество новых атомов.




Ещё никто не комментировал эту статью. Оставьте комментарий первым!