Физические и химические свойства сложных эфиров
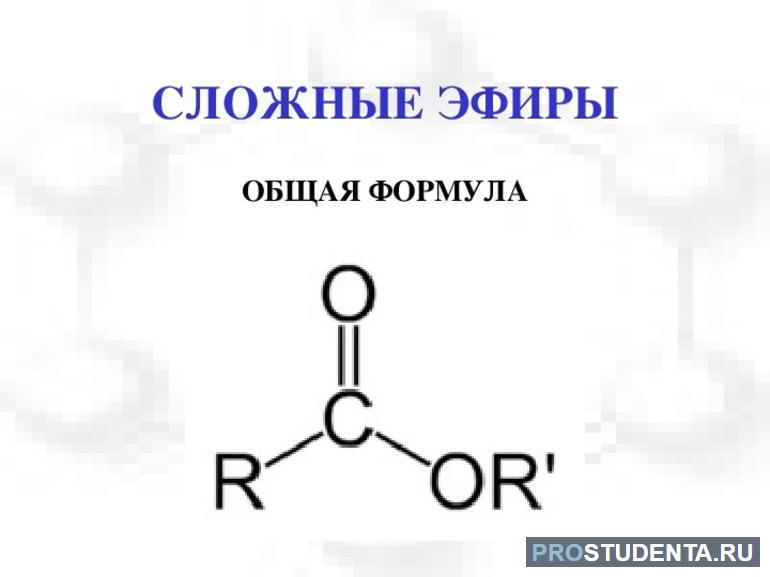
Сложные эфиры (эстеры) представляют собой остаток карбоновой кислоты, где атом водорода замещен на углеводородный радикал. Общая формула: R-C (O)-O-R'. Эти вещества широко распространены в природе, содержатся в цветах, фруктах и воске. Карбонильный углерод в молекуле и замещающий радикал определяют химические свойства сложных эфиров, основанных на реакциях с нуклеофилами и замещении алкоксигруппы.
Оглавление:
Сложные эфиры (эстеры) представляют собой остаток карбоновой кислоты, где атом водорода замещен на углеводородный радикал. Общая формула: R-C (O)-O-R'. Эти вещества широко распространены в природе, содержатся в цветах, фруктах и воске. Карбонильный углерод в молекуле и замещающий радикал определяют химические свойства сложных эфиров, основанных на реакциях с нуклеофилами и замещении алкоксигруппы.
Физические свойства
Природа кислоты и радикала определяет физические свойства сложных эфиров. От углеродного скелета зависит внешний вид вещества, температура плавления и кипения. В зависимости от длины углеродной цепочки эфиры делятся на три группы:
- фруктовые (цепочка состоит из не более 8 атомов углерода);
- жиры (атомов углерода насчитывается от 9 до 19);
- воск (более 20 атомов).
Низшие эстеры представляют собой бесцветные летучие жидкости, обладают приятным ароматом. Запах цветов, фруктов, ягод и эфирных масел обусловлен содержанием этих веществ. Производные высших кислот — это твердые вещества без запаха. Находятся в воске. Например, пчелиный воск содержит пальмитиновомирициловый эфир.
Представители этого класса соединений нерастворимы в воде, при смешивании получается двухфазная система, где эфир образует верхний слой. Температура плавления вещества зависит не только от длины углеродной цепи, но и от ее структуры, а также от строения радикала.
Химические реакции
В составе молекулы эстеров есть карбоксильная группа с замещенным атомом водорода. Именно эта часть определяет химические свойства эфиров. Атом кислорода в функциональной группе сильно поляризован. Благодаря этому связь С — О — R непрочная и очень легко разрывается. Эстеры способны вступать в следующие реакции:
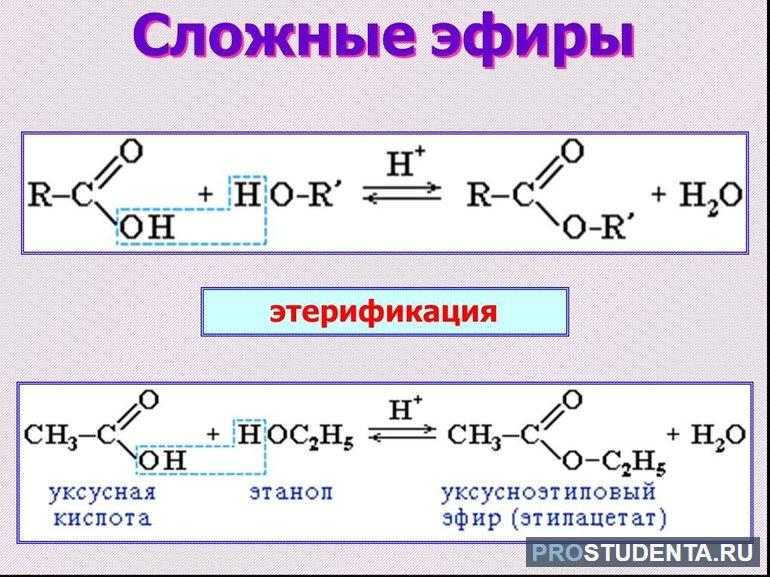
- Гидролиз. Основная химическая реакция, свойственная эфирам, — гидролиз или омыление. Суть её в том, что при гидратации эстеры распадаются на спирт и кислоту. Реакция протекает как в кислой, так и в щелочной среде. При катализации кислотой процесс называется этерификацией и протекает в обе стороны. Если в растворе присутствует щелочь (NaOH), гидролиз протекает необратимо и называется омылением. В результате образуются спирт и соль карбоновой кислоты. В производстве мыла используется гидролиз эфиров высших карбоновых кислот. Реакция омыления является качественной на эстеры.
- Восстановление водородом. При воздействии водорода на эстер связь С — О — R разрывается, и соединение восстанавливается до двух спиртов. Так, после гидрирования метилацетата образуются метиловый и этиловый спирты.
- Замещение аммиаком. Аммиак вытесняет из эстера замещающую группу. В итоге образуется амид соответствующей кислоты и спирт. Например, продуктами реакции уксуснопропилового эфира и аммиака являются амид уксусной кислоты и пропиловый спирт.
- Горение на воздухе. Сложные эфиры — органические соединения. Как и любая органика, они сгорают с образованием воды и углекислого газа. Уравнение реакции: С2О5С00СН3 + О2 = СО2 + Н2О.
Для непредельных эстеров характерны те же реакции, что и для любых других непредельных соединений. При взаимодействии с водородом происходит разрыв и восстановление ненасыщенной связи. Из жидких масел получают твердые жиры.
Соединения с двойной связью могут вступать в реакцию галогенирования. Например, при реакции с бромом (Br2) непредельная связь разрывается, и в места разрыва присоединяются атомы галогена.
Жиры, содержащие остатки непредельных карбоновых кислот, подвергаются окислению под действием кислорода с последующей реакцией поляризации. Механизм, по которому протекает окисление жиров, до конца неясен.
Получение эстеров
Сложные эфиры могут быть выделены из природных источников, например, из эфирных масел. Однако чаще эти вещества получают искусственно. Для этого есть 4 способа:
- этерификация;
- из солей кислот и галогенопроизводных;
- из хлорангидридов и алкоголятов;
- из ангидридов кислот.
Сложный эфир можно получить реакцией непосредственно между кислотой и спиртом. Такое взаимодействие носит название этерификация. Органические кислоты очень медленно реагируют со спиртом. Ускорить процесс можно при помощи добавления неорганических кислот и нагревания.
Этерификация обратима, обратный процесс называется гидролизом. В качестве катализатора чаще всего используют концентрированную серную кислоту. Она выполняет две функции: дает атом водорода, ускоряющий реакцию, и является осушителем. Связывание образовавшейся воды смещает химическое равновесие в сторону образования продуктов. Кроме связывания воды в промышленности обеспечивается отвод полученного эфира, чтобы провести этерификацию почти до конца.
Необратимо протекает реакция между солью карбоновой кислоты и галогенопроизводными. Например, уксусноэтиловый эфир образуется из ацетата серебра и хлористого этила. Этот метод предпочтительней этерификации, так как обладает хорошим выходом. Аналогично протекает взаимодействие алкоголятов и хлорангидридов.
Хорошим выходом также обладает реакция между ангидридом кислоты и спиртом с образованием эстера и воды. Например, уксусный ангидрид и этиловый спирт при взаимодействии образуют этилацетат.
Способы применения
Искусственные эссенции из эстеров используют в пищевой промышленности для приготовления фруктовых соков и кондитерской продукции. Эти же эссенции добавляют в косметические средства и бытовую химию в качестве отдушки.
Эстеры имеют важное значение для производства. При изготовлении резины и пластмассы эфиры добавляются в материалы для придания им эластичности и пластичности, то есть применяют в качестве пластификаторов.
Сложные эфиры представляют собой производные карбоновых кислот. Сложными их называют, чтобы отличать от производных органических спиртов — простых эфиров. Эти вещества содержатся в эфирных маслах, фруктах, цветах и обуславливают их запах. Из-за приятного аромата эстеры низших кислот используют в качестве ароматизаторов в косметической, фармацевтической и пищевой промышленностях.



Ещё никто не комментировал эту статью. Оставьте комментарий первым!