Раствор аммиака: химические свойства, формула, гидролиз
Нашатырным спиртом называют раствор аммиака либо гидроксид аммония. Химическое вещество активно используется не только в медицинской, но и в бытовой сфере. Гидроксид аммония применяется как пищевая добавка Е527. Это вещество относится к категории эмульгаторов. Благодаря физическим и химическим характеристикам гидроксид аммония используется в качестве регулятора кислотности. На уроках химии в 10 классе изучают формулу гидролиза раствора аммиака.
Оглавление:
Краткое описание
На европейских языках название аммиака (общая формула — NH3) звучит как «аммониак». Своим названием это химическое вещество обязано оазису Аммона, который находится на перекрёстке караванных путей в Северной Африке. Наиболее быстро мочевина (NH2)2CO, которая содержится в продуктах жизнедеятельности животных, подвергается разложению в жарком климате. В результате этой реакции образуется NH3.
Существует мнение, что своё название аммиак получил от слова «амониан», которое существовало в древнеегипетском языке. Именно так называли людей, которые поклонялись богу Амону.
В процессе проведения различных ритуальных обрядов люди вдыхали нашатырь, который в процессе нагревания испарял аммиак.
NH4OH (гидрат аммиака) применяется в современной промышленности как пищевая добавка Е527. Многие производители привыкли использовать другие названия эмульгатора. Например, гидроксид аммония. Раствор бесцветен, но имеет характерный запах. Пищевая добавка хорошо растворяется в Н2О. В производстве чаще всего используется сырьё синтетического происхождения. Это может быть аммиачная вода, которую получают благодаря соединению воды и кокосового газа.
Основная цель применения добавки Е527 — регулирование уровня кислотности. Но лабораторные исследования показали, что NH3·H2O является опасным для организма человека, из-за чего это вещество запрещено во многих страна. Применять пищевую добавку Е527 можно в России, Украине, странах ЕС.
Гидроксид аммония обладает щелочными свойствами, из-за чего это вещество в неразбавленном виде может вызывать серьёзные химические ожоги. NH4OH может вызывать аллергическую реакцию и раздражать не только слизистые оболочки, но и кожные покровы. По этой причине в косметических средствах NH3·H2O содержится в концентрации максимум 6%. Раствор аммиака присутствует в красках для волос, но не больше 3%. Избежать негативного воздействия косметических средств на организм можно в том случае, если в составе приобретаемых товаров не будет аммиачной воды.
Способы получения
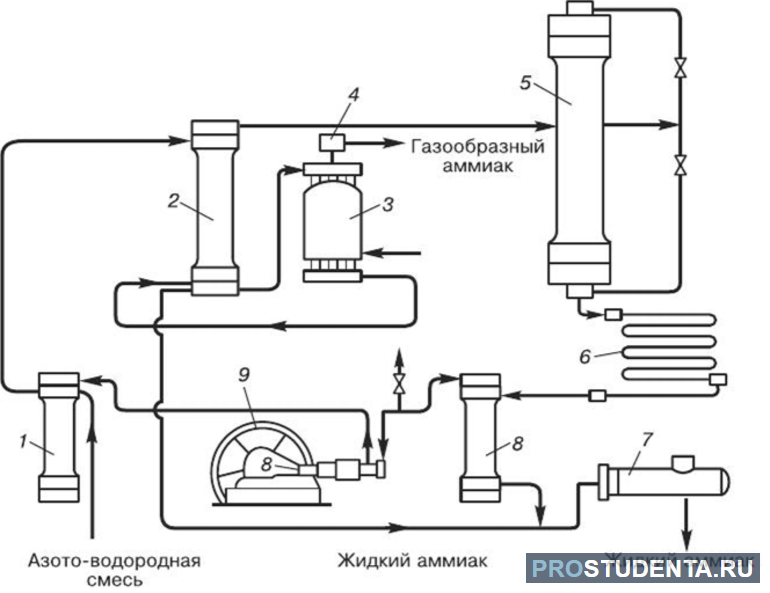
В промышленности NH4OH получают путём прямого воздействия азотной кислоты (HNO3) и водорода. Например: N2 (г) + 3H2 (г) ↔ 2NH3 (г) + 45,9 кДж. Физико-химические основы этого метода разработал немецкий учёный Габер. Реакция происходит с понижением давления и выделением тепла. Использование катализатора позволяет существенно ускорить достижение равновесного состояния. Учёным удалось установить, что для получения аммиака уровень давления должен составлять 350 атмосфер. Оптимальная температура — +500 °C. При использовании катализатора выход NH4OH находится в пределах 30%.
В промышленных условиях используется проверенный временем метод циркуляции. Аммиак удаляют охлаждением, а своевременно непрореагировавшие водород и азот возвращаются в колонну синтеза. Такой подход является более экономичным.
В лабораторных условиях для получения аммиака используется принцип воздействия сильных щелочей на соли аммония: NH4Cl + NaOH = NH3↑ + NaCl + H2O. Дополнительно может применяться слабый нагрев смеси хлорида аммония с гашёной известью. Эту химическую реакцию можно записать следующим образом: 2NH4Cl + Ca (OH)2 = CaCl2 + 2NH3↑ + 2H2O. Чтобы осушить NH3, жидкость пропускают через специальную смесь, состоящую из извести и гидроксида натрия.
Максимально сухой аммиак можно получить в том случае, если растворить в нём NaOH и подвергнуть последующему перегону. Лучше всего для этого использовать специальную установку с вакуумом, изготовленную из прочного металла. В противном случае не удастся задействовать высокое давление. В промышленной отрасли аммиак осушают только в колоннах абсорбционного типа.
Принцип строения
Молекула NH3 состоит из трёх атомов водорода и одного атома азота. Образуемая связь является ковалентной. Под микроскопом можно увидеть, что молекула аммиака напоминает треугольную пирамиду. Сразу 3 свободных электрона находятся на 2р-орбитали азота. Тип гибридизации sp3 образуется благодаря присоединению трём атомам водорода. Если попробовать заменить водород углеводородным радикалом (CnHm), то в итоге можно будет получить совершенно новое органическое вещество — амин. Замещаться могут сразу 3 атома водорода, за счёт чего образуются следующие виды аминов:
- Первичные. Метиламин (CH3NH2).
- Вторичные. Диметиламин (СН3-NH-СН3).
- Третичные. Триметиламин (СН3-N-(СН3)2).
К молекулам аммиака могут присоединяться различные химические вещества, которые содержат в своём составе несколько атомов водорода и углерода.
Например, (С2Н4)2, С2Н4 и С6Н4. У аминов и аммиаков похожие свойства, так как у них остаётся свободная пара электронов азота.
Химические свойства
В составе NH4OH степень окисления водорода +1, азота — -3. Водный раствор аммиака обладает слабыми щелочными свойствами. В различных условиях гидроксид аммония может проявлять свойства нерастворимого и растворимого основания. В результате реакции гидрокарбоната натрия (NaHCO3) и аммиака (NH3) образуется Na2CO3 и (NH4)2CO3. Существует несколько характеристик, которые могут подтвердить, что аммиачная вода является щёлочью:
- В результате взаимодействия с кислотами образуются кислые плюс средние соли. Химические реакции можно записать так: 2NH3·H2O + H2SO3 → NH4HSO3, 2NH3·H2O + H2SO3 → (NH4)2SO3 + 2H2O.
- Меняется окраска индикатора. Лакмусовая бумажка станет синей, метилоранж будет жёлтого цвета, а фенолфталеин — малинового.
- Аммиачная вода реагирует с кислотными оксидами, благодаря чему образуются соли. Например: SO3 + 2NH3·H2O → (NH4)2SO4 + 2H2O.
- NH4OH вступает в реакцию с солями: 3NH3·H2O + AlCl3 → Al (OH)3 + 3NH4Cl.
Раствор аммиака и нерастворимые основания похожи между собой, так как они реагируют с кислотами, легко разлагаются (NH3·H2O → NH3 + H2O). Но эти химические вещества не вступают в реакцию с амфотерными металлами, а также их гидроксидами и оксидами. NH4OH в результате взаимодействия с перманганатом калия проявляет свои восстановительные свойства. Например: 2NH4OH + 2KMnO4 → 2MnO2↓ + N2↑ + 2KOH + 4H2O.
Действие аммиака на хлорид серебра (AgCl+NH3) приводит к образованию комплексной соли — хлорида диамминсеребра. Дополнительно может использоваться (NH3OH)Cl (хлорид гидроксиламиния).
Благодаря своим химическим свойствам NH4OH получил большой спрос в традиционной медицине, в сфере серийного производства различных красителей, удобрений (например, нитрат аммония NH4NO3), соды. В бытовой отрасли аммиачную воду используют для очистки мебели, стёкол и текстиля от загрязнений.
Физические характеристики
Аммиак является бесцветным газом, который имеет резкий запах. NH3 гораздо легче воздуха, подвержен растворению в H20. Например, один объём воды может растворить до 700 объёмов аммиака. В концентрированной жидкости NH3 содержится 25% химического вещества. Показатель плотности раствора находится в пределах 0.91 г/см3. Все связи между атомами в молекуле аммиака являются ковалентными. На уроках химии можно узнать, что вид молекулы можно записать как АВ3. Для NH3 свойственна геометрическая структура типа АВ3Е (тригональная пирамида).
Сжижение аммиака происходит при температуре -33 °C. При охлаждении до -78 °C химическое вещество становится твёрдым. NH3 помогает растворить органические и неорганические вещества, но при этом не проводит электрический ток.
Свойства раствора аммиака повлияли на то, что это вещество используют в качестве надёжного средства скорой помощи для возбуждения дыхания, выведения человека из обморочного состояния. Местно жидкость применяют в качестве примочек при укусах насекомых, а также для эффективной нейтрализации кислых токсинов, которые фиксируются при укусах змей.
Концентрированный раствор аммиака является хорошим растворителем для большого количества органических и неорганических соединений. При правильном применении с помощью NH4OH можно растворить щёлочноземельные, щелочные металлы и другие вещества. К примеру, йод, фосфор, серу. В жидком аммиаке слабо растворяются хлористые, азотнокислые, бромистые соли. NH3 не воздействует на соли уксусной, угольной и фосфорной кислот. В чистом виде аммиак представляет собой диэлектрик, из-за чего может образовывать на стенках судов статическое электричество.
Сферы применения
Статистические данные подтверждают то, что по объёму производства NH3 занимает одно из лидирующих мест во всём мире. Ежегодно получают до 180 млн тонн этого химического соединения. Реализуется концентрированный NH3 в виде раствора. Можно приобрести NH4OH, в составе которого содержится максимум 25% главного химического вещества. Большие объёмы NH3 используются для получения HNO3 (азотная кислота), которая необходима для серийного производства удобрений и других товаров. Из аммиака получают:
- Мочевину (CH4N2O).
- Соли аммония.
- Уротропин.
Часто NH4OH используется в качестве бюджетного хладагента, когда речь касается промышленных холодильных установок. Благодаря аммиаку можно получить синтетические волокна. Например, капрон, нейлон. В сфере лёгкой промышленности NH4OH используются для очистки и последующего окрашивания шерсти, хлопка, шёлка. NH3 получил большой спрос в нефтехимической промышленности, так как с его помощью можно нейтрализовать кислотные отходы.
В сфере производства природного каучука NH4OH используется для сохранности латекса, когда нужно выполнить транспортировку сырья к месту переработки.
Если сода изготавливается по методу Сольве, тогда без аммиака не обойтись. В сталелитейной промышленности NH4OH используется для азотирования (процесс насыщения всех поверхностных слоёв стали азотом), так как благодаря такому подходу можно существенно повысить твёрдость материала. Только при правильном использовании раствора аммиака можно избежать токсичного воздействия на организм человека, не нанося вреда окружающей среде.







Ещё никто не комментировал эту статью. Оставьте комментарий первым!