Альдегиды и кетоны: физические и химические свойства
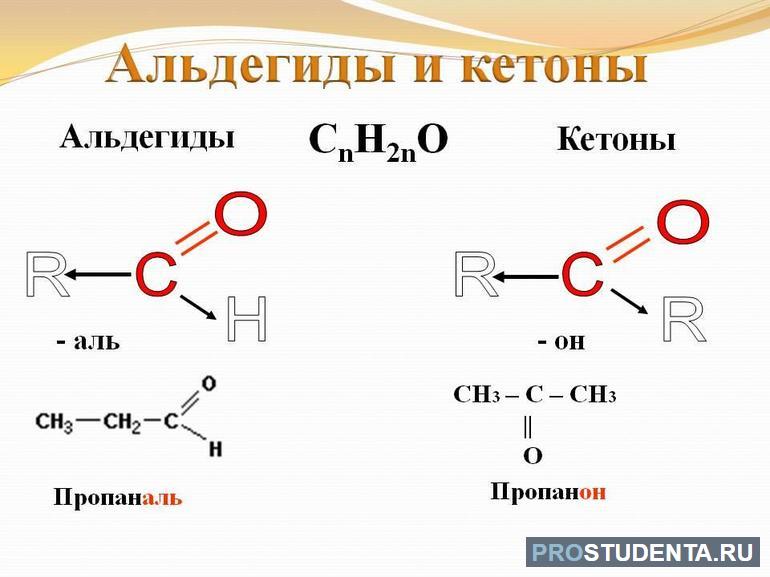
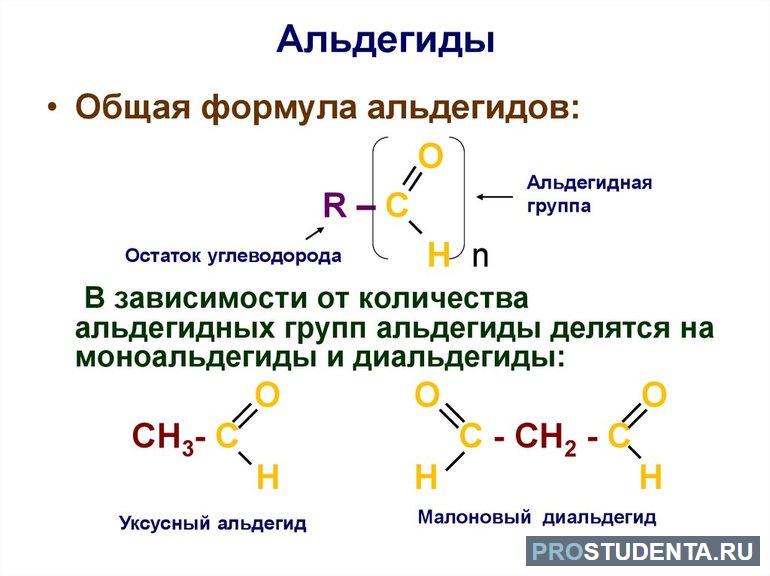
Карбонильными соединениями называют органические вещества, в состав которых входят молекулы полярной группы С=О. В зависимости от присутствующих заместителей, связанных с оксосоединениями, эти элементы делятся на альдегиды и кетоны. В первом случае с карбонильной группой связаны углеводородный радикал и атом водорода. Исключений не предусмотрено. В кетонах функциональная группа связана с двумя углеводородными радикалами.
Оглавление:
Краткое описание
Востребованный в промышленности метаналь (альдегид) представляет собой газ. Если в молекуле общее количество атомов углерода меньше 12, тогда химическое вещество будет иметь жидкую форму. Более длинные CnH2nO отличаются твёрдой структурой и не растворяются в воде. Альдегиды на химическом уровне гораздо активнее, нежели кетоны. Они свободно окисляются до карбоновых кислот и образуют сложные эфиры. Название вещества по международной номенклатуре (систематической) образуется от соответствующего алкана с таким же числом атомов углерода с добавлением окончания «аль», например, метаналь.
Альдегиды являются сильными восстановителями, поскольку могут легко перейти в состояние одноатомных спиртов. В результате химической реакции поликонденсации с фенолами образуются фенолформальдегидные смолы. CnH2nO взаимодействуют с реактивами Гриньяра, гидросульфатами, водно-спиртовыми растворами. При неосторожном использовании эти вещества являются токсичными, могут накапливаться в организме, ухудшая самочувствие человека.
Агрегатное состояние у кетонов (общая формула — R1-CO-R2) может меняться так же, как у альдегидов. Элементы быстро растворяются в воде, но имеют неприятный запах. Жидкие кетоны отличаются высокой летучестью, поскольку их итоговые химические значения гораздо выше, чем у карбоновых кислот и спиртов. R1-CO-R2 взаимодействуют со следующими элементами:
- аммиаком;
- ортокремниевой кислотой;
- гидросульфатами;
- гидразином;
- гидроксиламином.
R1-CO-R2 могут превращаться во вторичные спирты в результате химической реакции гидрирования и восстановления. Эти вещества ядовиты, они легко проникают через кожный покров, могут раздражать верхние дыхательные пути и слизистые оболочки.
Отличить кетоны от альдегидов можно с помощью качественной реакции. Подойдёт, например, «серебряное зеркало». По итогам взаимодействия аммиачного раствора окиси серебра и альдегида на стенках сосуда можно наблюдать блестящий слой чистого Ag. Функциональную карбонильную группу кетонов называют кетогруппой.
Принцип строения
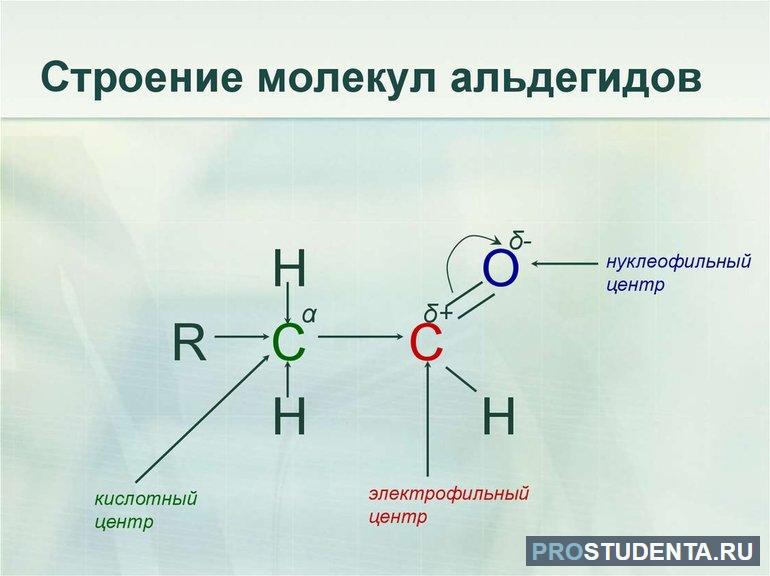
Химические свойства кетонов и альдегидов тесно связаны с наличием карбонильной группы. Высокая электроотрицательность атома О2 способствует достижению максимальной поляризации двойной связи в функциональной группе С=О. Подвижные тг-электроны связи смещаются в сторону атома кислорода, из-за чего он приобретает частичный отрицательный заряд. Лабораторные исследования показали, что для альдегидов и кетонов свойственны реакции своеобразного нуклеофильного присоединения. Полимеризация касается только двух первых гомологов CnH2nO.
Степень активности альдегидов и кетонов в реакциях присоединения зависит от классификации и фактической величины частичного положительного заряда на карбонильном атоме углерода. По своей природе это могут быть как предельные, так и непредельные соединения. Если алкильные радикалы связаны с функциональной группой С=О, тогда величина заряда будет уменьшена. По этой причине реакционная способность альдегидов в реакциях присоединения гораздо выше, чем у кетонов. Формальдегид является наиболее активным среди всех существующих CnH2nO.
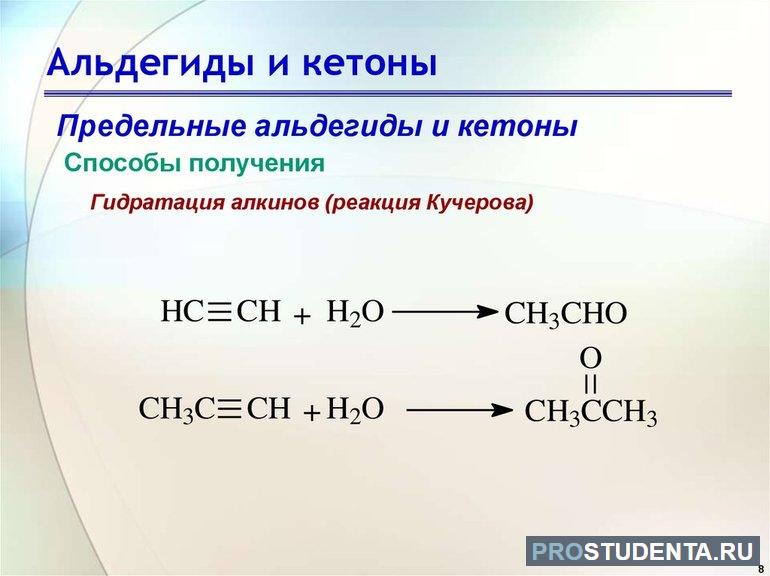
Способы получения
На уроках химии в 10 классе можно узнать, что альдегиды и кетоны (общая формула — CnH2nO) называются карбонильными соединениями. Основную информацию по этой теме следует кратко оформить в виде таблицы, чтобы в конспекте можно было быстро отыскать ответ на поставленный вопрос. CnH2nO пользуются большим спросом в различных отраслях современной промышленности. Для получения альдегидов и кетонов используются следующие доступные способы:
- Окисление CnH2n+1OH. В лабораторных условиях карбонильные соединения получают в результате окисления спиртов. Дополнительно используются сильные окислители, например, дихромат или перманганат калия.
- Подвергание бариевых и кальциевых солей карбоновых кислот пиролизу. Кетоны и альдегиды можно получить в результате постепенного нагревания химических элементов до отметки +300 °C. CnH2nO образуются благодаря использованию НСООН.
- Гидратация алкинов. Используется химическая реакция Кучерова, которая стала известна человечеству в 1881 году. При присутствии концентрированной серной кислоты и сульфата ртути при температуре +200 °C происходит гидратация ацетилена и его гомологов. В итоге образуются уксусный альдегид и кетоны. Сегодня этот способ получения CnH2nO практически не используется, так как формируемые элементы сильно загрязнены солями ртути.
- Дегидрирование CnH2n+1OH. В промышленности чаще всего используется именно этот способ получения CnH2nO. Весь процесс протекает в газовой фазе. Обязательно применяется металлический катализатор (аргентум, силициум, никель, платина). Температура должна быть в пределах +300 °C. Окислители не используются.
В лабораторных условиях не менее востребованным является гидролиз дигалогеналканов. Чтобы получить альдегид, два атома галогена должны присоединиться к первому атому углерода. В результате этой химической реакции можно получить двухатомные спирты. Имеющиеся две Он-группы будут максимально приближены к одному атому углерода. Но такие химические соединения являются неустойчивыми, так как распадаются на карбонильные соединения и Н2О.
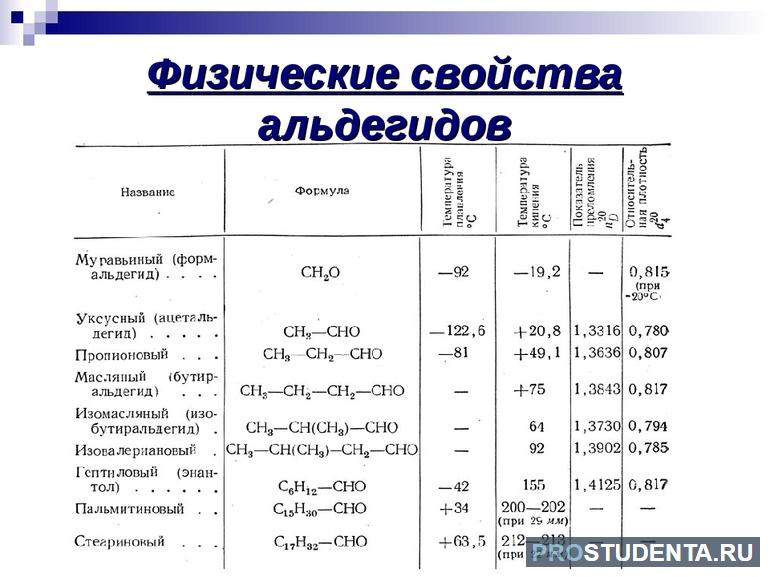
Физические характеристики
В условиях комнатной температуры и при небольшом давлении альдегиды и кетоны являются бесцветными жидкостями либо твёрдыми веществами с ярко выраженным запахом. Высшие CnH2nO отличаются наличием приятного цветочного аромата, из-за чего получили спрос в сфере серийного производства парфюмерии. Карбонильные соединения обладают высокой полярностью, что связано с некоторыми физическими свойствами этих веществ. Для альдегидов и кетонов свойственна более высокая температура кипения, чем для углеводородов. Это можно объяснить наличием межмолекулярного взаимодействия.
Водородные связи не могут образовывать карбонильные соединения, из-за чего нет необходимости использовать высокую температуру для закипания этих веществ. Низшие кетоны и альдегиды отлично растворяются в Н2О. Но с пятого элемента гомологического ряда процент растворимости в воде постепенно снижается.
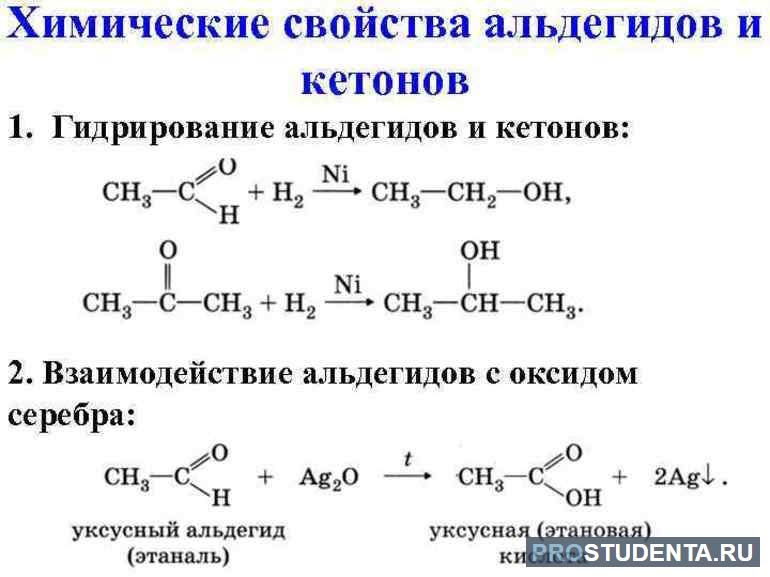
Химические свойства
Для альдегидов и кетонов свойственны реакции присоединения по карбонильной группе. Это утверждение является ключевым отличием альдегидов от карбоновых кислот. В последнем случае реакции присоединения исключены. Среди основных химических свойств CnH2nO можно выделить:
- Окисление альдегидов. Углекислый газ и вода образуются в результате полного окисления, горения. Эту химическую реакцию можно записать так: 2CH3CHO + 5O2 → 4CO2 + 4H2O. В лабораторных условиях альдегиды легко окисляются до карбоновых кислот. Весь процесс тесно связан с известной реакцией «серебряное зеркало». Кетоны, в отличие от альдегидов, не подвержены окислению.
- Реакции присоединения. В карбонильной группе кислород притягивает к себе электронную пару от углерода. На атоме О2 возникнет частичный отрицательный заряд, а на углероде — положительный. Химическая реакция гидрирования альдегидов основана на присоединении, но этот процесс влечёт за собой разрыв в карбонильной группе двойной связи. Гидрирование кетонов позволяет получить вторичные спирты. В случае с альдегидами будут образованы первичные CnH2n+1OH.
Если используется реакция «серебряного зеркала», тогда при окислении метаналя будет образована НСООН, которая практически мгновенно окислится до СН2О3. Угольная кислота распадётся на Н2О и СО2. Это связано с наличием в муравьиной кислоте альдегидной группы.
Для окисления можно задействовать гидроксид меди (II). Эта химическая реакция является качественной для альдегидов. Если всё сделать правильно, то в итоге образуется кирпично-красный осадок оксида меди.
Сферы применения
Среди существующих карбонильных соединений наибольший спрос получили формальдегид, ацетон и ацетальдегид. Н-СНО (метаналь, муравьиный альдегид) применяется в сфере серийного производства карбамидных и фенолформальдегидных смол, пластмассы. Это химическое вещество используется для синтеза медикаментозных средств (уротропина), а также для органических продуктов. Формальдегид является мощным дезинфицирующим средством и надёжным консервантом анатомических и биологических препаратов. Н-СНО используется для обработки изделий из натуральной кожи.
Водный раствор формалина (40%) получил большой спрос в народном хозяйстве, поскольку его физические свойства позволяют свёртывать белок, за счёт чего он становится более плотным, не растворяется в Н2О, а также не подвержен гниению. НСНО отлично сохраняет костный материал, который крайне важен для восстановления живых тканей и проведения различных пластических операций.
Раствор формальдегида используется для дезинфекции помещений и хирургических инструментов. Формалин получил спрос и в сельском хозяйстве, так как этой жидкостью обрабатывают семена, чтобы защитить их от личинок вредителей.
Для получения фенолформальдегидной смолы используют метаналь. Это вещество применяется для серийного производства пластмассы (фенопластов). Фенолформальдегидные смолы входят в состав различных лаков, клеев, красок, эмалей, политуры. Усовершенствованный полиформальдегид используют для серийного производства плёночных изделий.
C8H8O3 (ванилин) представляет собой ароматическое вещество, которое получило спрос в пищевой и парфюмерной промышленности. Но в последние несколько лет гораздо чаще используют аналогичное вещество синтетического происхождения, добавляемое в кондитерские изделия в качестве ароматизатора. Ванилин является исходным элементом в синтезе лекарственного средства Фтивазид, действие которого направлено на борьбу с туберкулёзом. Благодаря современным технологиям специалисты научились использовать альдегиды и кетоны без вреда для людей и окружающей среды.



Ещё никто не комментировал эту статью. Оставьте комментарий первым!