Получение азота, аммиака и азотной кислоты
Первым в истории, кто занимался описанием и получением азотной кислоты, был арабский алхимик Джабир ибн Хайян, описавший различные химические операции, в том числе изложивший способ приобретения её слабого раствора. В высоких концентрациях она была впервые получена только в XVII веке немецким алхимиком И. Глаубером. В 20-х годах XIX века Ж. Гей-Люссак вывел формулу, которая закрепилась и используется при обозначении азотной кислоты по сей день.
Оглавление:
Азот и его свойства
У всех элементов группы азота характерны степени окисления от -3 до +5. Электронный уровень состоит из двух электронов в f-состоянии и 3 электронов в р состоянии. Электроны атома этого элемента образуют три типа гибридных орбиталей. Азот входит в линейные, плоские треугольные и пространственные тетраэдрические молекулы.
Известно, что азотосодержащие молекулы играют огромную роль в биологических процессах. В состав растений и живых организмов входят аминокислоты, витамины, ферменты и нуклеиновые кислоты. Этот газ есть в таких жизненно важных соединениях, как хлорофилл и гемоглобин.
При открытии элемента шотландский химик Даниель Резерфорд называл его «удушливым воздухом», а французский ученый Лавуазье в 1787 году дал ему имя азот — «безжизненный». В английском, испанском, венгерском и норвежском используется производное от этого слова — «нитроген».
В природе этот элемент встречается главным образом в виде газа, молекула которого двухатомная. Он занимает около 78 процентов объема воздуха и имеет следующие физические свойства:
- при обычной температуре не имеет запаха, вкуса и цвета, плохо растворяется в воде, плотность 1,2506 кг/м³;
- в жидком состоянии — кипит при температуре 195,8 °C. Жидкость похожа на воду, она бесцветная и подвижная, плотностью 808 кг/ м³, взаимодействуя с воздухом, поглощает кислород.
- при температуре -209,86 °C переходит в твердое состояние, превращаясь в массу в виде снега или большие белоснежные кристаллы. Взаимодействуя с атмосферой, также поглощает кислород, при этом плавится и образует раствор кислорода в азоте.
Из атмосферы его получают путем фракционного разделения воздуха, который фильтруется от пыли и поступает пятиступенчатый компрессор. После трех ступеней сжатия воздух из компрессора подается в скрубберы, где осуществляется связывание углекислого газа с раствором щелочи. Очищенный, он дожимается в компрессоре до 200 атмосфер. Далее в специальных емкостях происходит охлаждение за счет его расширения.
Воздух сжижается и подвергается двойной ректификации в колонне. В результате этого он разделяется на азот и кислород. Перевозят и хранят жидкий газ в сосудах Дьюара, имеющих различные размеры.
Использование в индустрии
Так, большие объемы жидкого нитрогена транспортируют в железнодорожных изотермических вагонах-цистернах, газообразный азот в сжатом виде перевозят в баллонах черного цвета. Применение его в жидком виде, как охлаждающего вещества, открывает новые возможности в развитии сельского хозяйства, медицины и биологии. Клеточные культуры животных и человека могут годами сохраняться при температуре минус 196 градусов Цельсия.
Газ в жидком состоянии применяется для достижения низких температур криогенной техники. Газообразный азот используют для повышения твердости и коррозийной устойчивости металлических деталей. После азотирования детали не требуют дополнительной обработки и срок их службы значительно возрастает.
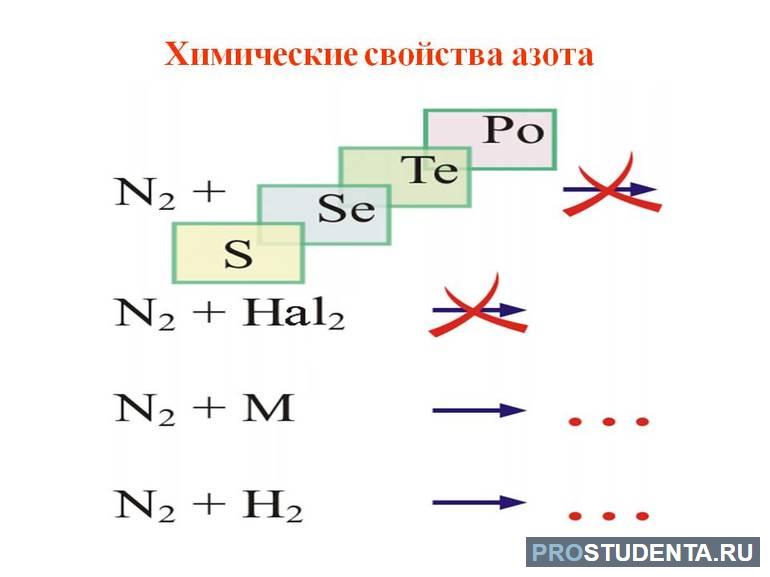
Его также применяют как инертную среду для заполнения различных ламп и термометров. Азот — самая стабильная из всех двухатомных молекул. Тройная связь, одна из которых сигма и две p, прочно объединяет два атома.
Промышленный синтез аммиака
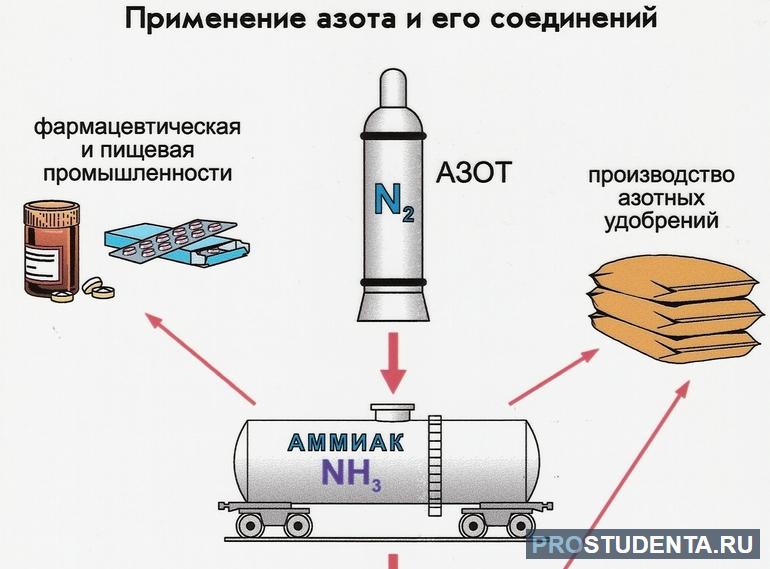
Бинарное неорганическое химическое соединение азота и водорода образует аммиак, из которого в последующем получают азотную кислоту. Многие химические свойства этого элемента определяются наличием неподеленной пары электронов атома азота.
При взаимодействии с сильными кислотами он образует соли аммония. Элемент отдает свою неподеленную пару электронов катиону водорода, возникает комплексный ион аммония с четырьмя равноценными связями, азот — водород. Как донор электронной пары, азот аммиака выступает в качестве лигандов в комплексных соединениях переходных металлов.
При добавлении водного раствора этого соединения осадок хлорида серебра растворяется. Координационное число серебра в аминокомплексах равно двум, меди — четырем, никеля и хрома — шести.
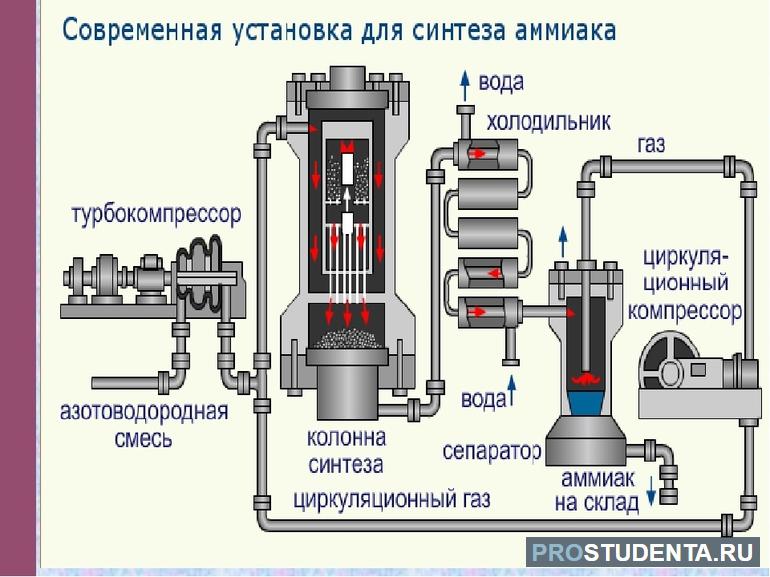
Промышленный синтез аммиака из водорода и азота можно назвать образцом современного химического производства. Управление полностью автоматизировано и осуществляется с центрального пульта. Высокая эффективность и мощность производства во многом зависит от катализаторов, применяемых на всех стадиях процесса. В производстве аммиака используется вода, природный газ и воздух, из которых в результате газокаталитических процессов образуется азотоводородная смесь.
Она последовательно очищается от примесей и поступает в четырехступенчатый компрессор. Синтез аммиака идет под давлением триста атмосфер. Из компрессора эта смесь через сепаратор и теплообменники поступает в колонну синтеза, где расположен катализатор. Азотоводородная смесь нагревается выходящим из колонны газом и последовательно проходит слои катализатора, в каждом из которых идет образование аммиака.
Применение аммиака и его водных растворов:
- в сельском хозяйстве в качестве удобрений;
- в криогенной технике используется как холодильный агент;
- в медицине известен как нашатырный спирт;
- в качестве противоморозной добавки для сухих строительных растворов.
Интересные факты: облака на Юпитере состоят из аммиака, а некоторые цветы, не имеющие запаха от природы, после обработки этим веществом начинают благоухать. Пары нашатырного спирта способны изменять окраску цветов: голубые и синие лепестки станут зелеными.
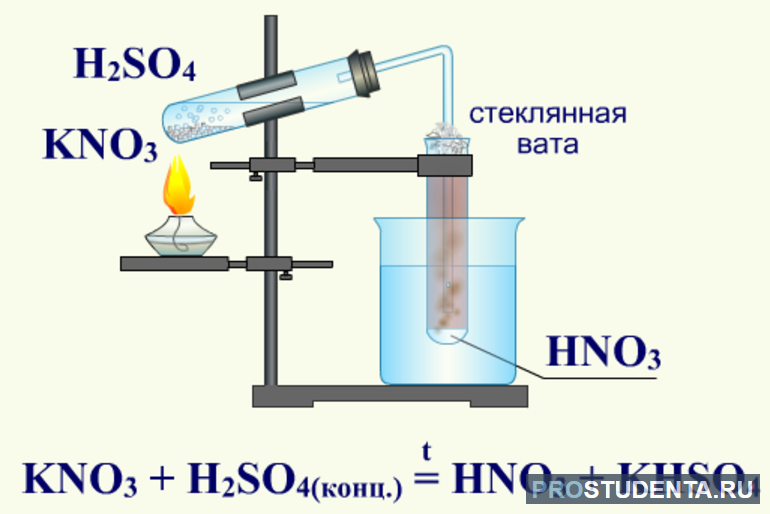
Получение азотной кислоты
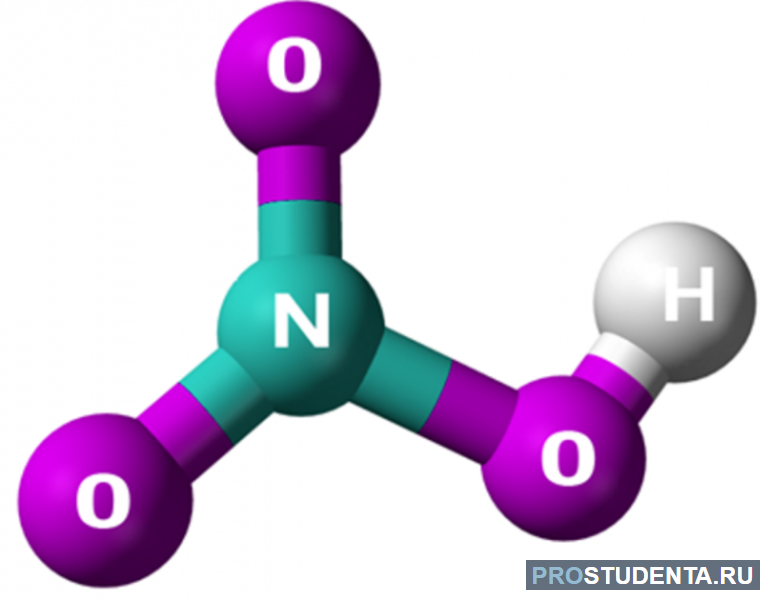
Степень окисления атома азота в азотной кислоте максимальна и равна плюс пяти. Она энергичный окислитель. Углерод, сера, фосфор под её действием превращаются в оксиды. Металлы при взаимодействии с раствором этого химического соединения не вытесняют водород.
Глубина восстановления кислоты зависит от её концентрации и активности металла. Железо, алюминий, хром растворяются в разбавленной кислоте, а в концентрированной поверхность этих металлов пассируется, покрывается защитной оксидной пленкой. Поэтому медь из раствора медного купороса не осаждается на железном стержне, выдержанном в концентрированной кислоте.
Производство этого химического вещества автоматизировано и основано на каталитическом окислении аммиака кислородом. Из атмосферы он проходит через фильтры в турбокомпрессор, где давление его увеличивается до 6−7 атмосфер.
Воздух и газообразный аммиак подогреваются и направляются в смеситель. Смесь подается в контактный аппарат, где происходит реакция окисления аммиака. Температура катализатора поддерживается за счет тепла, выделяющегося в реакции.
Выходящие из контактного аппарата нитрозные газы охлаждаются в котле-утилизаторе. При охлаждении нитрозных газов оксид азота превращается в диоксид. В холодильнике из газовой смеси конденсируется вода. Она и образует с диоксидом азота азотную кислоту.
В абсорбционной колонне завершается процесс получения этого химического продукта. При движении от верхней тарелки к нижней, концентрация раствора увеличивается, достигая на выходе 58 процентов. В продувочной колонне из нее удаляются растворенные газы. Полученный продукт поступает в хранилище.
Применение в народном хозяйстве
Около 80 процентов получаемой кислоты используется для производства простых и сложных минеральных удобрений.
Кроме того, она широко применяется:
- в производстве красителей и лаков;
- при изготовлении пластмасс и синтетических волокон;
- как окислитель в ракетной технике;
- для получения взрывчатых веществ — динамита, тола, пироксилина;
- для травления печатных форм в типографии;
- в производстве лекарств;
- для определения золота в сплавах;
- для получения органических соединений.
Бурное развитие промышленности и широкая химизация сельского хозяйства, которые во многом связаны с химией азота, ставят проблему охраны окружающей среды.
Оксиды азота — ядовитые вещества, образуются при сгорании различного топлива. Содержание оксидов в газах, выбрасываемых в атмосферу, снижают путем каталитической очистки. Эффективность очистки регулярно контролируется заводскими лаборатории.
Защита атмосферы от загрязнений является актуальной проблемой всех стран с развитой промышленностью. В промышленных городах созданы специальные службы охраны воздуха. За содержанием вредных примесей в атмосфере ведется тщательный и постоянный контроль. В то же время в природе существуют системы, совершенно безвредно связывающие молекулярный азот. На корнях бобовых растений живут бактерии, которые переводят этот элемент в аммиак.
Полностью механизм работы бактерий пока не совсем ясен. Известно, что этот процесс протекает при участии фермента — нитрогеназы. Также, например, непонятно, как в процессе инкубации азот из воздуха проникает внутрь куриных яиц и превращается в сложные соединения: аминокислоты и белки. Изучение природного механизма фиксации и восстановления азота — одна из наиболее актуальных проблем современной науки.






Ещё никто не комментировал эту статью. Оставьте комментарий первым!