Строение атома азота и его валентные возможности
Азот (N) — химический элемент, имеет в таблице Менделеева порядковый номер 7. Расположен в V группе, главной подгруппе, во втором периоде. Относится к неметаллам. На внешнем уровне у него находятся 5 электронов, 3 из них не спарены. Именно они, а также одна неподеленная электронная пара определяют валентные возможности азота. Его максимальная степень окисления +5, а значение валентности не превышает IV.
Оглавление:
Азот (N) — химический элемент, имеет в таблице Менделеева порядковый номер 7. Расположен в V группе, главной подгруппе, во втором периоде. Относится к неметаллам. На внешнем уровне у него находятся 5 электронов, 3 из них не спарены. Именно они, а также одна неподеленная электронная пара определяют валентные возможности азота. Его максимальная степень окисления +5, а значение валентности не превышает IV.
Электронное строение
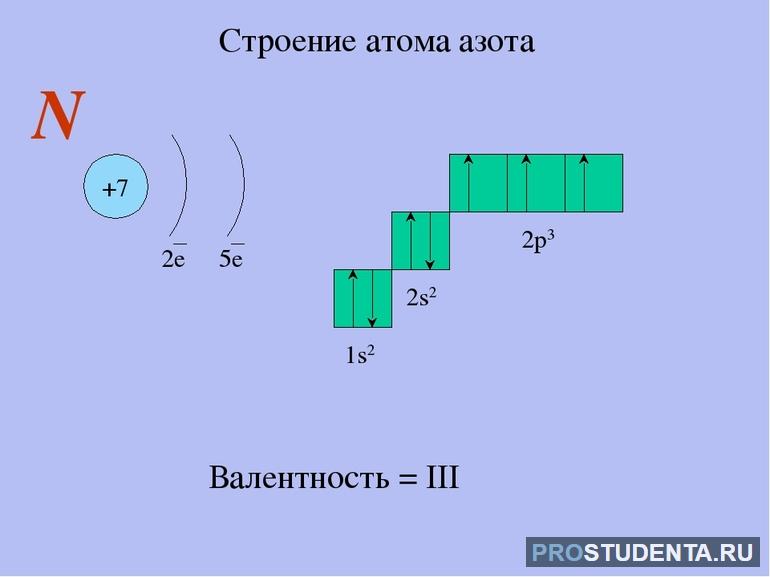
Порядковый номер азота 7, то есть всего у него имеется 7 электронов. Второй период свидетельствует, что они находятся на двух энергетических уровнях. На внешнем расположены 5 электронов. Энергетическое строение атома азота выглядит так 1s2 2s2 2p3.
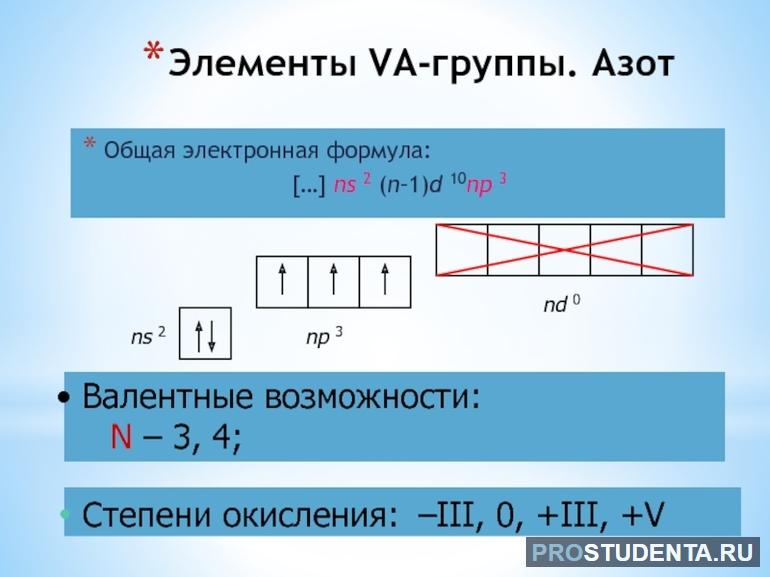
До завершения заполнения внешнего слоя азоту нужно принять недостающие 3 электрона или отдать 5 имеющихся. Таким образом, минимальная степень окисления элемента -3, а самая высокая +5. Из-за этого долгое время считалось, что N — пятивалентный элемент. Однако, более глубокое изучение показало, что низшее и высшее валентное значение для него будут I и IV.
Расчет валентности
Валентность — число химических связей, которые может образовать элемент. Значение этого показателя не может превышать количество свободных орбиталей на внешнем уровне элемента. Электроны, участвующие в связывании, называются валентными.
У азота 3 неспаренных электрона на p-орбитали способны образовывать 3 ковалентные связи по обменному механизму. Такая тройная связь наблюдается, например, в простом веществе N2. Или в молекуле аммиака NH3, где азот создает по одной связи с тремя атомами водорода. То есть, благодаря незаполненной р-орбитали, азот проявляет валентность III.
Но у него на внешнем уровне есть неподеленная пара на s-орбитали. Она может создавать одну связь по донорно-акцепторному механизму. Это добавляет еще одну валентность атому. В целом элемент можно охарактеризовать как четырехвалентный. Таким образом, возможные валентные значения могут быть:
- I (N2O);
- II (NO);
- III (N2O3, N2);
- IV (HNO3, N2O5).
Степень окисления элемента и его валентные возможности не всегда совпадают. Например, в азотной кислоте (формула HNO3) содержится 3 двухвалентных кислорода. Один из трех элементов принимает по одному электрону от водорода и азота. Второй атом кислорода получает на свою р-орбиталь оставшиеся 2 неспаренных электрона с р-орбитали N. И этот же элемент связан с последним кислородом по донорно-акцепторному механизму при помощи неподеленной пары с подуровня s. Таким образом, элемент N находится в своей максимальной степени окисления +5, а его валентность равняется IV. Аналогичным образом строятся связи в оксиде азота V.
У некоторых элементов может наблюдаться возбуждение. Возбужденное состояние характеризуется перескоком электрона на свободную орбиталь. Элемент при этом нестабилен и существует недолго, но в этот краткий период валентность увеличивается. У N нет свободных орбиталей, на которые может перейти электрон, поэтому IV — это максимальное валентное значение для него.
Примеры задач
Задача: определить валентность азота в следующих соединениях: AgNO3, HNO2, N2H4.
Чтобы определить неизвестную валентность атома в молекуле, нужно знать ее значение для других составляющих атомов и рассчитать, сколько кратных единиц приходится на них. Вычислить нужно следующим образом:
- Нитрат серебра AgNO3. На внешнем уровне аргентум имеет только один неспаренный электрон, значит, может образовать только одну химическую связь. Для кислорода валентное значение всегда будет II, 3 атома должны вместе обладать валентностью VI. Один из кислородов связан с серебром. 6 — 1 = 5. Оставшиеся электроны кислород получает от N, при этом пара электронов образует одну связь. То есть у N в молекуле нитрата серебра валентность IV.
- Азотистая кислота HNO2. Валентность кислорода II, количество этого элемента в молекуле тоже два. 2*2 = 4. Водород является одновалентным. 4 — 1 = 3. Итого валентное значение N равняется III.
- Гидразин N2H4. Атом водорода имеет валентность I. 4 * 1 = 4. Атома азота в молекуле гидразина два, поэтому 4 нужно поделить пополам и получится 2. Валентность N в молекуле гидразина равна II.
Атом азота имеет 5 электронов на внешнем уровне. Два из них находятся на s-орбитали, а другие 3 расположены на р-орбитали. Благодаря трём неспаренным электронам и одной неподеленной паре, элемент имеет валентности от I до IV.



Ещё никто не комментировал эту статью. Оставьте комментарий первым!