Формула пероксида водорода, его химические свойства и применение
Самое известное вещество, которое используют люди для обработки ссадин и царапин, — перекись (пероксид) водорода с формулой H2O2. Но на самом деле это соединение благодаря необычности своего строения и химических свойств имеет более широкое значение. Оно используется во многих отраслях промышленности (вплоть до производства ракетного топлива), а также применяется в быту для целей, не связанных с медициной.
Оглавление:
Самое известное вещество, которое используют люди для обработки ссадин и царапин, — перекись (пероксид) водорода с формулой H2O2. Но на самом деле это соединение благодаря необычности своего строения и химических свойств имеет более широкое значение. Оно используется во многих отраслях промышленности (вплоть до производства ракетного топлива), а также применяется в быту для целей, не связанных с медициной.
Основные характеристики
В обычном состоянии перекись водорода — это прозрачная жидкость, не обладающая выделяющимся запахом и имеющая специфический «металлический» привкус. В чистом виде H2O2 взрывоопасна. При температуре -0,5 °C замерзает.
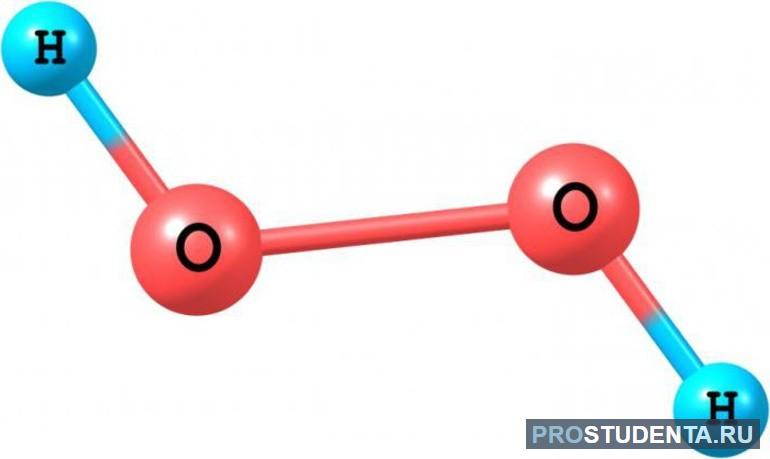
Молекула пероксида сильно полярная (из-за несимметричности строения). Ее структурная формула H-O-O-H, то есть содержит кислородную связь O-O, которая является очень слабой, поэтому вещество нестойкое, быстро разлагается, хорошо растворяется в воде, эфире, спиртах.
Пероксидная группа (-O-O-) имеет степень окисления -2. Однако формально у каждого атома кислорода в молекуле степень окисления равна -1, а у водорода она составляет +1, то есть записывается это как H2+1O2-1. Аналогично будет происходить и в других пероксидных соединениях: например, Na2O2, Ba2O2 и т. д.
Пергидроль (еще одно название H2O2) — сильный окислитель (относится к классу кислот). Его концентрированные растворы вызывают сильные ожоги (аптечные средства, к которым все привыкли, имеют массовую долю вещества всего лишь 3%). Бумага, опилки и другие быстровоспламеняющиеся вещества при соприкосновении с перекисью быстро загораются.
Получение соединения
В лабораториях соединение получают путем взаимодействия пероксида бария и серной кислоты: BaO2 + H2SO4 → BaSO4 (осадок) + H2O2. Однако на практике такой способ получения нецелесообразен, так как из-за химических особенностей исходных веществ выход итогового продукта получается небольшим, поэтому в процессе синтеза чаще используют соляную кислоту: BaO2 + 2HCl → BaCl2 + H2O2. Полученный хлорид бария осаждают серной кислотой. В промышленности применяют другие методы:
- Электролиз раствора серной кислоты (или сульфата аммония). 2HSO4- -2e → H2S2O8 (двунадсерная кислота); H2S2O8 + 2HOH (вода) → 2H2SO4 + H2O2.
- Окисление водорода кислородом воздуха (антрахиноновый процесс).
- Процесс окисления изопропилового спирта (ИПС — вещество, обладающее антисептическими свойствами). (CH3)2CHOH + O2 → H2O2 + (CH3)2CO (ацетон). Но эта реакция для промышленного производства применяется редко.
Примечательно, что следы пероксида водорода всегда присутствуют в составе атмосферы. Кроме того, он частично образуется как побочный продукт при окислении кислородом воздуха ряда природных веществ, а также в пламени горящего водорода.
Химические свойства
Пергидроль — это слабая двухосновная кислота. Но в химических реакциях соединение может проявлять как окислительные, так и восстановительные свойства. В процессах окисления оно распадается на воду и свободный кислород (реакция схематическая): H2O2 → H2O + O. Этому способствует кислая среда.
Значительно менее характерными будут восстановительные свойства. В этом случае разложение пройдет по схеме: H2O2 → O2 + 2H. Примеры:
- Окислительные признаки. 2KI + H2O2 + H2SO4 → K2SO4 + I2 + 2H2O; PbS (сульфид свинца) + 4H2O2 → PbSO4 + 4H2O.
- Восстановительные качества. 5H2O2 + 2KMnO4 + 3H2SO4 → 2KMnSO4 + K2SO4 + 5O2 + 8H2O; 2AgNO3 + H2O2 → 2Ag + O2 + 2HNO3.
На самом деле в том, какие свойства будет проявлять пергидроль, есть определенная закономерность: в кислой среде соединение проявляет себя как окислитель, а в щелочной выступает восстановителем. H2O2 — более сильная кислота, чем простая вода.
Практическое использование вещества
Перекись водорода активно используется во многих отраслях промышленности. Но основное применение — медицина:
- Для обеззараживания ран и ссадин перекись наносят прямо на поврежденную кожу (если область небольшая). С помощью этого средства можно также остановить слабое кровотечение.
- При лечении фурункулеза и акне.
- Для лечения стоматита. Появившиеся язвочки можно как прижигать ватным тампоном, на который нанесена перекись, так и полоскать этим медикаментом, но разбавленным водой.
- Водный раствор аптечного пероксида поможет избавиться от неприятного запаха изо рта.
- При насморке слабоконцентрированный раствор аптечного средства используют для промывания носа.
- Для лечения отита, избавления от ушной серы, в виде препарата для премедикации при промывании ушей (размягчает серные пробки).
- В качестве антимикозного средства при лечении грибковых заболеваний стоп (снимает зуд).
- Для купирования зубной боли при стоматологических воспалениях.
Однако это не единственный вариант использования перекиси водорода. Например, она необходима при синтезе органических веществ (получение эпоксидов, полиуретанов, ПВХ), в аналитической химии (производство пористых материалов, пенообразователей), используется как катализатор, гидрирующий агент.
Благодаря своим окислительным свойствам H2O2 может быть использована как топливо (ракетное, для турбонасосов). Необходима перекись и в пищевой промышленности для обеззараживания поверхностей и упаковок.
Используют пергидроль и в сфере красоты в качестве окислителя при окрашивании и обесцвечивании волос. А еще с помощью этого вещества можно удалять разнообразные пятна с одежды. На самом деле вариантов применения перекиси водорода очень много. Это действительно «многофункциональное» соединение.




Ещё никто не комментировал эту статью. Оставьте комментарий первым!