Водородные соединения: гидриды и их свойства
H2 - это элемент IА-группы, порядковый № 1. Заряд атомного ядра +1, потому что в ядре 1 протон. Вокруг ядра вращается всего 1 электрон. До завершения уровня атому не хватает 1 электрона. Завершать энергетический уровень атом водорода может различными способами: образовывать летучие водородные соединения и гидриды.
Оглавление:
H2 - это элемент IА-группы, порядковый № 1. Заряд атомного ядра +1, потому что в ядре 1 протон. Вокруг ядра вращается всего 1 электрон. До завершения уровня атому не хватает 1 электрона. Завершать энергетический уровень атом водорода может различными способами: образовывать летучие водородные соединения и гидриды.
Способы завершения энергетического уровня
Водород — один из немногих химических элементов, который может иметь как положительную, так и отрицательную степень окисления в соединениях. Как, например, бром ( NaBr -1, Br +1 2O ) и хлор ( NaCl -1, HClO3+5):
- Может принимать на внешний уровень один недостающий электрон – атом водорода превращается в ион, заряженный отрицательно. Такая реакция происходит при взаимодействии с металлами, которые в соединениях проявляют только положительную степень окисления. Степень окисления водорода будет равна -1, так как заряд отрицательный. Металлы с H2 создают соединения, которые называются гидридами. Способствует их образованию H2 с самыми активными металлами: щелочными и щелочноземельными. Например: NaH (гидрид натрия), CaH2 (гидрид кальция), LiH (гидрид лития), CuH (гидрид меди).
- Может отдавать один электрон со своего внешнего энергетического уровня — остается только ядро атома водорода, состоящее из протона. Таким образом, H2 образует химические соединения с неметаллами, которые при этом будут проявлять только отрицательную степень окисления. В соединениях с водородом степень окисления неметалла будет низшая. В этом случае водород становится частицей с положительным зарядом иона или степенью окисления +1. Соединения H2 с неметаллами называют летучие водородные соединения. Например: HCl (соляная кислота/хлороводород), NH3 (водородное соединение азота — аммиак), NH4OH (нашатырный спирт), NaHS (гидросульфид натрия).
Помимо способов завершения энергетического уровня, существует классификация гидридов, в соответствии с их характером связи. Они подразделяются на 3 большие группы.
Типы гидридов
Стоит рассмотреть основные группы, поскольку побочные группы (полимерные, интерметаллические и комплексные) являются подвидами основных, а также имеют схожие с ними физические и химические свойства.
Ионные гидриды
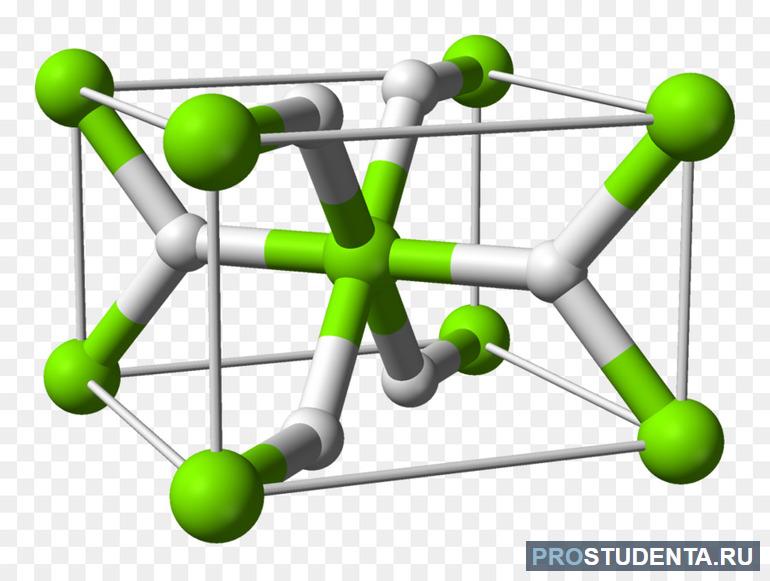
Ионные (солеобразные) — соединения H2 с металлами IA и IIA (кроме магния), а также с алюминием. Их главное отличие от двух других видов в том, что они активно реагируют с H2O с образованием щёлочи и выделением H2 в виде газа. Самым ярким представителем ионных гидридов является гидрид натрия.
Физические свойства: белые твёрдые вещества с кристаллической решёткой, содержащей катион (плюс) металла и гидрид-анион (минус) Н–. Проводят электрический ток. Устойчивы при нормальных условиях (н.у.).
Как и любое вещество (химический элемент, простое вещество или химическое соединение), ионные гидриды обладают свойствами. Они проявляются в процессе реакции и влияют на неё. Химические свойства:
- Разлагаются при нагревании еще до достижения своей температуры плавления: CaH2 = Ca + H2↑.
- При растирании на воздухе воспламеняются: CaH2 + O2 = CaO + H2O.
- Реагирует с водой с образованием щелочи и выделением водорода: 2NaH + H2O = 2NaOH + H2↑.
- Являются сильными восстановителями (при t 700-800°С восстанавливают оксиды до металлов), но их использование в лаборатории осложнено, поскольку они с легкостью реагируют с кислородом и влагой воздуха.
Применение: для получения металлов из их оксидов, удаления окалины с поверхности металлических изделий, как ракетное топливо.
Получение: при взаимодействии металлов с водородом при t 200-600°С:
- H2 + 2Na = (300°C) 2NaH;
- H2 + Ca = (600°C) CaH2.
Ковалентные соединения
Ковалентные — гидриды, образованные неметаллами IV, V, VI и VII групп, а также бором. Например, гидрид углерода/метан CH4, силан SiH4, гидрид серы/сероводород H2S.
Физические свойства: газообразные, легко воспламеняются на воздухе.
Ковалентные гидриды во многом отличаются от ионных и металлических. Если последние обладают химическими свойствами, схожими с металлами, то свойства ковалентных следует рассмотреть подробнее. Химические свойства:
- При высоких температурах разлагаются практически необратимо: H2S = (около 400°С) S + H2.
- Сильные восстановители.
- Высокая токсичность.
- B2H6 и SiH4 разлагаются водой с выделением водорода: B2H6 + 6H2O → 2H3BO3 + 6H2.
- Гидриды элементов V-VII групп не разлагаются водой.
Применение: для получения полупроводниковых пленочных покрытий, защитных покрытий на поверхности металлов.
Получение: термическое разложение, восстановление галогенидов.
Существуют многочисленные производные ковалентных гидридов, в которых часть атомов H2 замещена атомами галогенов или металлов.
Магний по своим свойствам и химической связи располагается между ионными и ковалентными гидридами. С водой и водными растворами MgH2 реагирует с выделением H2, но не так энергично, как ионные гидриды.
Соединения железа с водородом крайней неустойчивы и в чистом виде не обнаружены. Формула неустойчивого гидрида железа выглядит так: C5H5Fe.
Металлические соединения
Металлические — соединения переходных металлов. Фактически они являются твёрдым раствором H2 в металле, атомы водорода помещаются в кристаллическую решётку металла. Их образованию всегда способствует адсорбция водорода на поверхности металла.
Физические свойства: представляют собой кристаллические вещества с металлическим блеском. Обладают интенсивной окраской, проявляют металлические или полупроводниковые свойства. Устойчивы на воздухе. С кислородом и водой реагируют медленно. Магнитными, механическими, тепло- и электропроводными свойствами схожи с металлами.
Химическая связь очень прочная.
Применение: применяются в качестве источников водорода особой чистоты (который используется в топливных элементах), также для удаления водорода из газовых смесей.
Получение: реакция металла с водородом при обычной температуре или при нагревании: Ti + H2 = (150-200°С) TiH2.
При взаимодействии H2 с интерметаллическими соединениями, такими как TiFe, LaNi5, можно получить гидриды интерметаллидов TiFeH2, LaNi5H6, которые с высокой скоростью обратимо поглощают водород при атмосферном давлении.
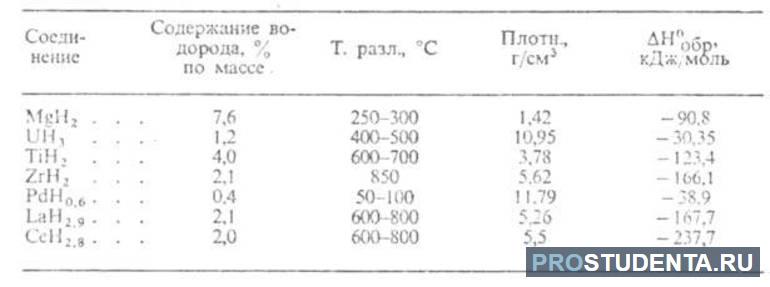
В прикрепленных таблицах указано содержание водорода, температура разложения, плотность и пр., что поможет в более глубоком понимании физических свойств водорода разных типов гидридов.
Особенности водородных соединений
Как и в любом разделе химии, водородные соединения имеют свои исключения. В их числе He, Ne, Ar, Kr, Pm, Os, Ir, Rn, Fr и Ra. Они не образуют бинарные соединения с водородом.
Информация, изложенная выше доказывает то, что химия интереснейший и увлекательный предмет, который стоит потраченного внимания и времени.




Ещё никто не комментировал эту статью. Оставьте комментарий первым!