Спирты и фенолы: химические свойства, классификация
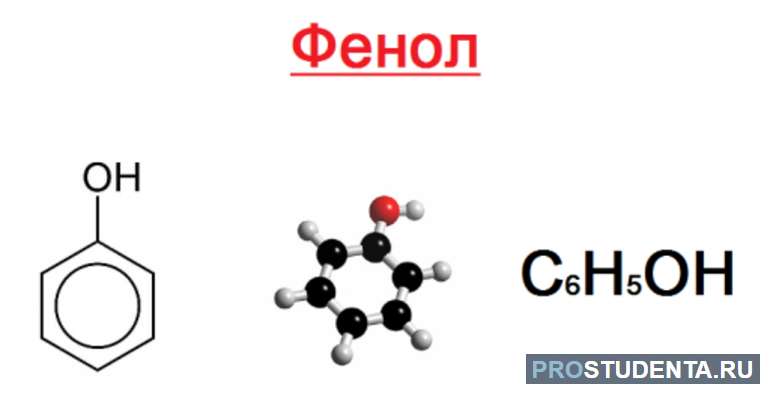
Гидроксисоединения относятся к категории органических веществ. Их молекулы содержат углеводородную цепь, а также функциональную группу ОН. Гидроксисоединения делятся на фенолы и спирты. Эти органические вещества получили большой спрос в различных отраслях. По характеру радикала спирты делятся на насыщенные и ненасыщенные. Если гидроксогруппа ОН соединена с бензольным кольцом, то такое вещество будет относиться к фенолам.
Оглавление:
Краткое описание
Существует большое количество методов, с помощью которых можно получить спирт. Все доступные способы можно разделить на две категории:
- Биохимический. Спирт получают из природного растительного сырья.
- Химический. В лабораторных условиях при помощи специальных элементов получают спирт.
Оба способа изучают на уроках химии. Классификация спиртов зависит от присутствующего в составе углеводородного радикала. По этой причине выделяют предельную, непредельную, а также ароматическую группу, каждая из которых обладает определёнными характеристиками.
Для получения спиртов из карбонильных соединений применяется реакция восстановления. В этом случае используется каталитическое гидрирование. Восстановление возможно и в том случае, если различные доноры гидрид анионов будут действовать на кетоны и альдегиды. При последнем гидролизе образуется качественное органическое вещество.
Многоатомные спирты можно получить несколькими химическими способами:
- Мягкое окисление алкенов (гидроксилирование по Вагнеру).
- Щелочной гидролиз. В этом случае происходит нуклеофильное замещение атомов галогена на гидроксильные группы.
- Раскрытие эпоксидных циклов водой.
- Восстановление карбонильных соединений, которые содержат в своём составе функциональную гидроксильную группу.
Не менее востребованной является реакция Гриньяра. Во время этого металлорганического химического процесса алкилмагнийгалогениды выступают в роли нуклеофилов. Реакция Гриньяра представляет собой важный метод создания углеродной связи. При взаимодействии задействованного реактива с карбонильными соединениями образуется спирт.
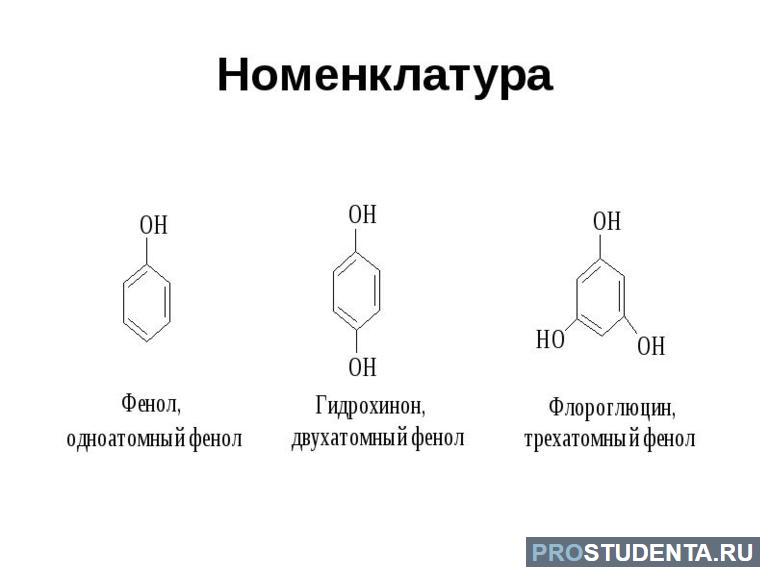
Номенклатура фенолов и ароматических спиртов
Чтобы правильно составить название ароматического спирта, обязательно используются действующие правила международной номенклатуры. Первым делом учитывается цепь, в состав которой входит гидроксильная группа. В роли заместителя выступает бензольное ядро (радикал — фенил). При использовании систематической номенклатуры должны быть учтены следующие нюансы:
- Углеводородную цепь можно нумеровать только с конца, к которому группа ОН расположена ближе всего. В противном случае будет допущена грубая ошибка.
- Полученную нумерацию используют для того, чтобы вдоль основной цепи можно было указать положение различных заместителей.
- В конце названия должен присутствовать суффикс «ол». Дополнительно должна присутствовать цифра, которая будет указывать положение группы ОН.
В качестве примера можно рассмотреть ароматический спирт, который обладает структурной формулой: С6Н5 — СН (СН3) — СН (ОН) — СН3. Тривиальное название актуально в отношении фенолов. Такой подход в химии сложился исторически.
Если речь касается замещённых моноядерных фенолов, тогда могут использоваться следующие приставки: «мета», «орто», «пара». Это правило изучают на уроках химии в 10 классе, когда учащиеся должны разобраться в номенклатуре ароматических соединений.
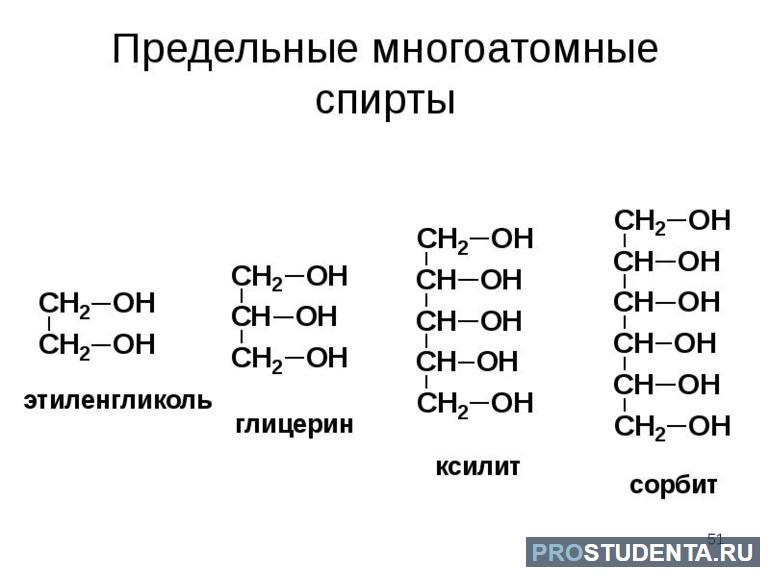
Многоатомные органические соединения
Многоатомные спирты вступают в реакцию со щелочами, щёлочноземельными металлами, а также алюминием (должен быть заранее очищен от защитного покрытия Al2O3). Для замещения может использоваться любое количество атомов водорода.
Молекулы многоатомных спиртов воздействуют друг на друга благодаря отрицательному индуктивному эффекту. В результате связь О-Н становится менее выраженной, а вот кислотные свойства гидроксильных групп стремительно возрастают. Высокая кислотность многоатомных спиртов заметна в том случае, когда они взаимодействуют с гидроксидами тяжёлых металлов.
Для лучшего усвоения правила следует рассмотреть пример. Свежеосажденный гидроксид меди реагирует на многоатомные спирты с последующим образованием раствора комплексного соединения. Жидкость будет окрашена в синий цвет. Эта реакция является качественной по отношению к многоатомным спиртам.
Сложный эфир азотной кислоты и глицерина, который называется тринитроглицерином, относится к разряду взрывчатых веществ. Если использовать этот раствор в концентрации 1%, тогда можно будет добиться мощного сосудорасширяющего эффекта, что очень важно для снижения вероятности возникновения инфаркта и инсульта.
Специфичность элиминирования
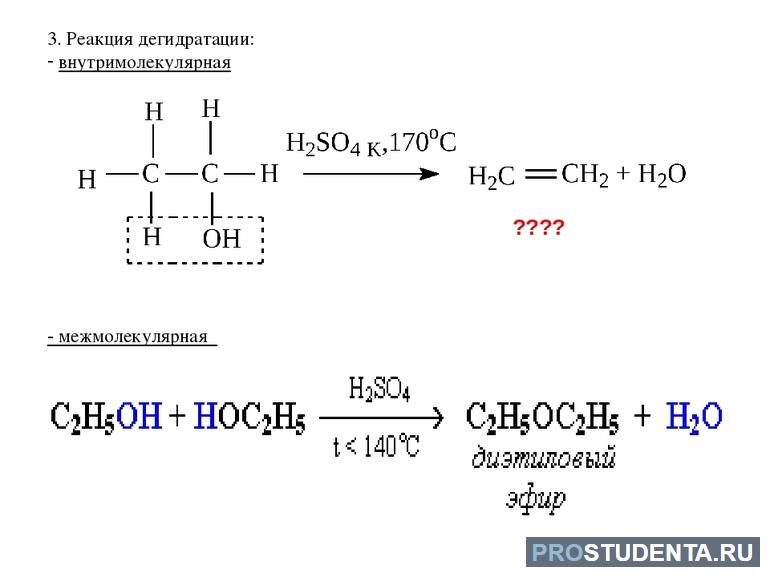
В процессе дегидратации происходит отщепление молекул Н2О. Этот процесс отличается своей специфичностью. Если речь касается спиртов, тогда может использоваться дегидратация внутримолекулярного, а также межмолекулярного типа. В последнем случае 1 молекула Н2О образуется благодаря отщеплению атома водорода от спирта и гидроксильной группы. По итогам такой химической реакции образуются соединения, которые относятся к разряду простых эфиров. Этот процесс можно записать с помощью формулы: C2H5-O-H + C2H5-O — H → C2H5-O — C2H5 + H2O.
Внутримолекулярная дегидратация отличается тем, что молекулы Н2О и C₂H₅OH разделяются. Но такая химическая реакция подразумевает соблюдение более жёстких условий, так как нужно использовать сильное нагревание. При несоблюдении основных правил добиться желаемого результата не получится. Внутримолекулярная дегидратация подразумевает то, что из одной молекулы C₂H₅OH образуется алкен и вода.
Если используется метанол, тогда возможно образование одного эфира СН3-О-СН3. Необходимое внутримолекулярное отщепление Н2О будет происходить в соответствии с действующим правилом Зайцева в том случае, если произойдёт дегидратация несимметричных спиртов. Например, водород сможет отщепляться от гидрированного атома углерода.
Физические свойства, токсичность С6Н5ОН
В нормальных условиях многие одноатомные фенолы представляют собой бесцветные кристаллические вещества, которые обладают характерным запахом. Для С6Н5ОН свойственна невысокая температура плавления. Фенолы практически не растворяются в воде, чего нельзя сказать об органических растворителях. С6Н5ОН — токсичное химическое вещество, которое в условиях хранения на открытом воздухе постепенно темнеет в результате окисления.
Фенол является бесцветным кристаллическим веществом. Под воздействием кислорода С6Н5ОН окисляется и приобретает розовый оттенок. Если нагреть фенол до отметки +60 °C или больше, тогда он смешается с водой в любом соотношении.
С6Н5ОН — токсичное вещество, которое вызывает ожоги кожи, а также серьёзные нарушения функций нервной системы. Раствор, пыль, а также пары фенола раздражают слизистые оболочки зрительного аппарата, дыхательных путей и кожного покрова. При попадании в организм С6Н5ОН быстро проникает в кровоток, из-за чего через 5−10 минут начинает воздействовать на ткани головного мозга, вызывая тем самым паралич дыхательного центра.
Даже при взаимодействии с минимальной концентрацией фенола не исключены приступы кашля, чихание, тошнота, а также общий упадок сил. С6Н5ОН может спровоцировать развитие онкологического заболевания, так как это вещество обладает мощным канцерогенным эффектом.
Сферы применения
Спирты и фенолы отличаются широким спектром использования. Эти органические соединения являются производными углеводородов. Благодаря антисептическим свойствам фенол используется для дезинфекции помещений, белья. Среди основных сфер применения можно выделить:
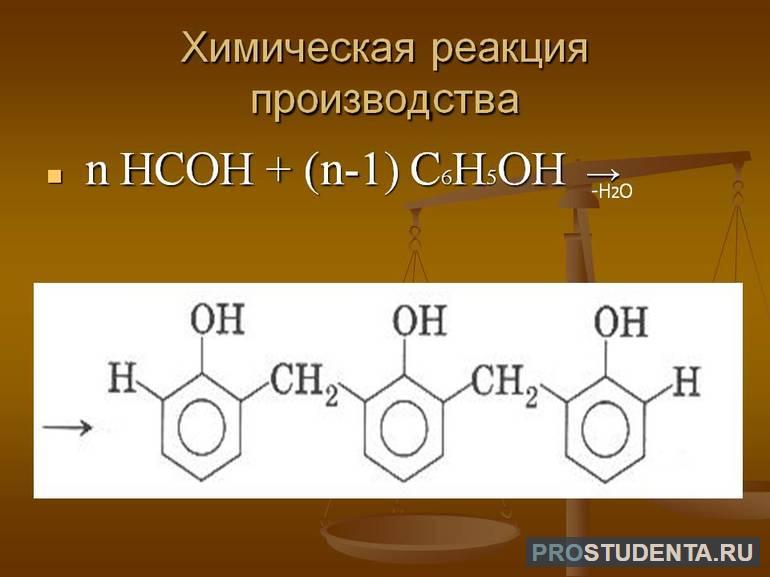
- Производство различных пластических масс. Например, ДФП и фенолформальдегидные смолы.
- Изготовление высококачественных красителей. Фенол используется в этой отрасли в связи с тем, что под воздействием кислорода может менять свой цвет.
- Генная инженерия и молекулярная биология. C6H5OH участвует в очищении и выведении ДНК из клетки совместно с метилтрихлоридом.
- Переработка добываемой нефти. Фенол обладает большой эффективностью, когда нужно качественно удалить смолистые вещества, содержащие маслянистые соединения.
- Серийное производство искусственного волокна. Например, капрона, нейлона.
- Фармацевтическая и медицинская отрасль. Фенол используется для производства ацетилсалициловой кислоты.
- Изготовление парфюмерии.
- Производство различных пластифицирующих составов для полимеров.
- Фенол используется в качестве реагента в аналитической химии.
- Дезинфекционная обработка шкур животных. C6H5OH входит в состав кожно-меховых дубителей.
Ранее фенол использовался для изготовления высококачественных строительных материалов, пластика, бытовых товаров, а также детских игрушек. Сегодня применение этого химического вещества сведено к минимуму, так как в лабораторных условиях было доказано, что C6H5OH плохо влияет на организм человека.



Ещё никто не комментировал эту статью. Оставьте комментарий первым!