Структура, свойства и функции белков (биология, 10 класс)
Биополимеры — необходимые компоненты всех живых организмов, они имеют большое значение для жизнедеятельности клетки. Полисахариды выступают как основной источник энергии, липиды защищают органы от механических воздействий, нуклеиновые кислоты хранят наследственную информацию. Не менее важными являются и функции белков. На биологии в 10 классе дети подробно рассматривают эту тему.
Оглавление:
Структура и строение
Белки (протеины, полипептиды) — полимерные органические соединения, состоящие из образованной пептидной связью цепочки альфа-аминокислот. Их структура делится на четыре уровня:
- Первичная подразумевает под собой нуклеотидную последовательность, определяемую генетическим кодом белка.
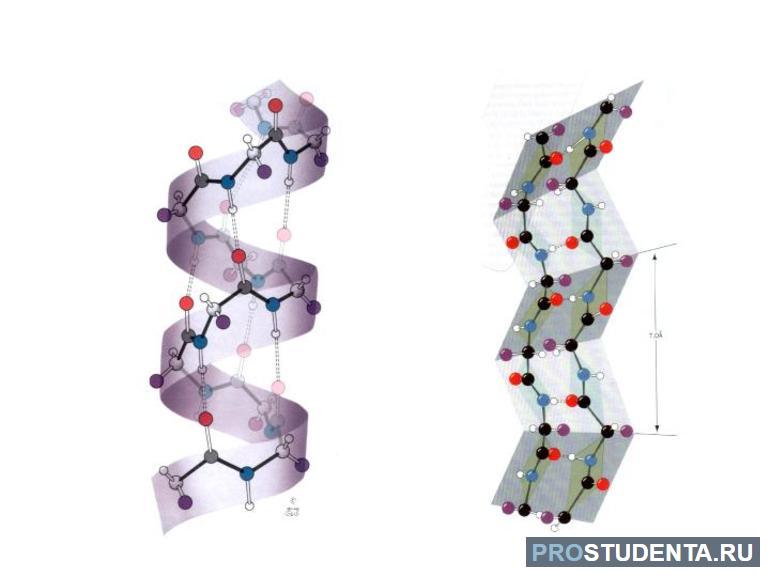
- Вторичная, как и структуры более высоких порядков, формируется в процессе сворачивания полипептидной цепи в спирали, складчатые зигзагообразные слои или неупорядоченные фрагменты, стабилизированные водородными связями.
- Третичная структура определяется первичной и составлена из элементов вторичной, стабилизированных в большей степени гидрофобными взаимодействиями, а также ковалентными, ионными и водородными связями.
- Четвертичная представляет собой формирование макромолекулярного образования из отдельных полипептидных цепей.
Уровень структурной организации может меняться. В зависимости от внешних условий белок принимает предпочтительную или энергетически более выгодную конформацию.
Также протеины классифицируются по типу строения. По этому признаку их можно разбить на три группы:
- Фибриллярные имеют вытянутую нитевидную структуру. Чаще всего они не растворяются в воде и имеют большую массу. Примерами таких полипептидов выступают кератин волос, коллаген сухожилий и хрящей, эластин сосудов и лёгких.
- Глобулярные представляют собой плотно свёрнутые в сферическую форму водорастворимые молекулы. К ним относятся ферменты, антитела, некоторые гормоны, например, инсулин.
- Мембранные встроены в молекулярную структуру, отделяющую содержимое клетки и её органелл от внешней среды. Они могут взаимодействовать с одной поверхностью мембраны либо пронизывать её насквозь один или несколько раз. Такое строение имеет белок, входящий в зрительный пигмент.
Характерные свойства
Одна из главных характеристик протеина — его размер. Он выражается в количестве аминокислотных остатков или килодальтонах. Рекордсменом является белок поперечно-полосатых мышц под названием коннектин. Он состоит из более чем 38 тысяч аминокислот, а его молекулярная масса превышает 3 тысячи килодальтон.
Другой важной характеристикой являются физико-химические свойства полипептидов. Главные из них следующие:
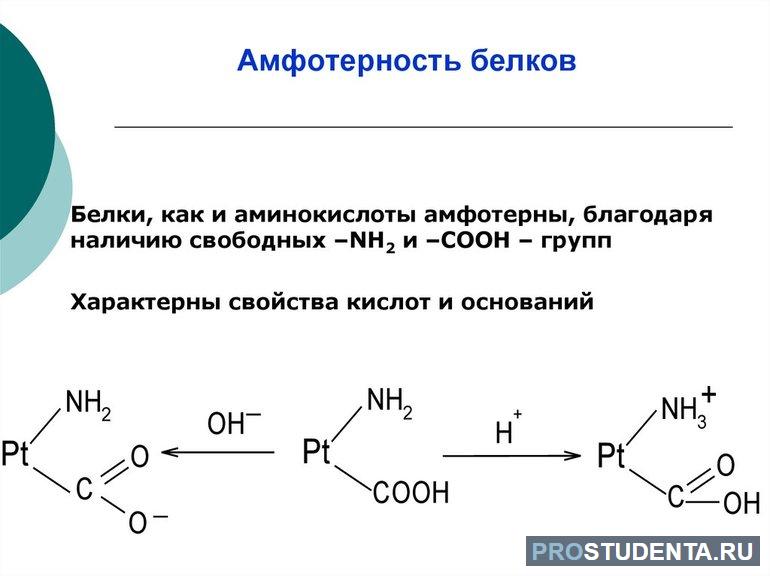
- Амфотерность. Протеины содержат в своём составе кислые и основные аминокислотные остатки, следовательно, в зависимости от условий в химических реакциях они могут как отдавать электронную пару, так и принимать её.
- Растворимость. В зависимости от структуры и внешних факторов полипептиды делятся на водорастворимые (к ним относятся сыворотка крови и яичный альбумин), нерастворимые (кератин, фиброин) и водоотталкивающие (мембранные белки).
- Денатурация. Химическое, физическое или механическое воздействие на протеины может привести к тому, что они полностью или частично потеряют вторичную, третичную либо четвертичную структуру.
Выполняемые функции
Один и тот же белок может производить различную работу в организме. Например, осуществлять процессы метаболизма, выступать в качестве строительного материала компонентов клетки, участвовать в передаче сигналов, гидролизе пищи, образовании структур ткани. Выполнение протеином разных функций даёт основу для их следующей классификации:
- Каталитическая. Белки, являющиеся ферментами, ускоряют химические реакции. В рамках живого организма это могут быть процессы окисления или метаболического распада сложного вещества либо, наоборот, явления синтеза высокомолекулярных соединений.
- Структурная. Полипептиды участвуют в изменении формы клеток и её органоидов, а затем в виде цитоскелета поддерживают её контуры. Кроме того, они входят в состав соединительных тканей, волос и ногтей человека, а также перьев птиц и раковин беспозвоночных.
- Защитная. Протеины, выполняющие структурную функцию, одновременно обеспечивают безопасность клеток, выступая своего рода арматурой для них. Помимо физической защиты они осуществляют и химическую, связывая отравляющие вещества и ускоряя реакции их выведения, а также иммунную, заключающуюся в нейтрализации белковых токсинов и других патогенов.
- Регуляторная. Полипептиды способны к приёму и передаче информации, специфическому связыванию с другими молекулами и ферментативной активности. За счёт этого они регулируют внутриклеточные процессы, например, транскрипцию, трансляцию, активацию или блокировку других белков.
- Сигнальная. Когда определённые протеины, например, гормоны, связываются с рецепторами, запускается ответная реакция. Таким образом даётся сигнал, помогающий клеткам взаимодействовать между собой, а системам организма обеспечивать согласованность действий.
- Транспортная. Полипептиды переносят химические соединения внутри и между клетками. Кровью осуществляется транспорт веществ по всему организму.
- Запасная. Некоторые белки запасаются теплом в качестве источника энергии. Также они могут давать организму аминокислоты, которые преобразуются в биологически активные вещества и регулируют обменные процессы.
- Рецепторная. В цитоплазме и мембране находятся протеины, воспринимающие сигнал и с помощью изменения собственной пространственной конфигурации передающие его другим клеточным компонентам.
- Двигательная. Сокращение мышц, перемещения тела в пространстве и клеток внутри организма были бы невозможны без моторных белков. Они преобразуют химическую энергию в механическую работу, транспортируют молекулы и органоиды.
Методы изучения
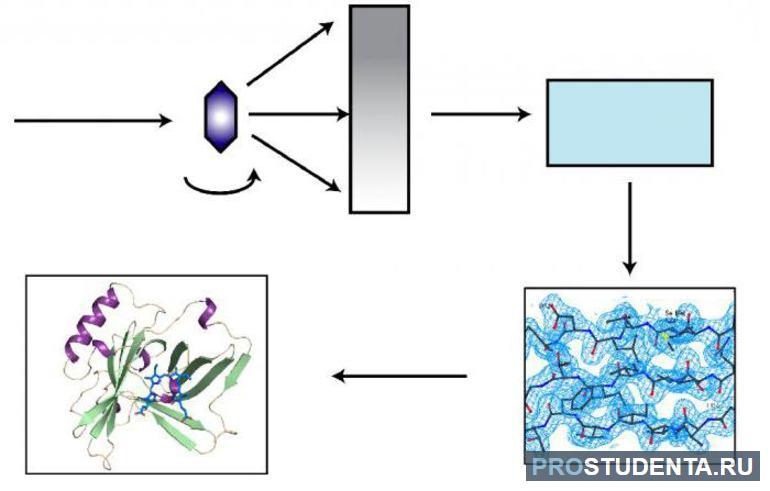
Структура, строение, свойства и функции протеинов определяются путём сложного анализа. Объекты могут помещаться на очищенные препараты и проходить испытания в контролируемых условиях, а также исследоваться в естественном окружении в отдельных клетках или целых организмах.
Определение состава белка впервые было проведено методом секвенирования. Сейчас для этого также используются рентгеноструктурный анализ, ядерно-магнитный резонанс и некоторые виды микроскопии.
Техники молекулярной и клеточной биологии помогают изучить процесс синтеза и локализации белка в клетке, а биохимические методы готовят протеин к опытам вне живого организма, для которых он должен быть очищен от других компонентов.
Это достигается путём генетической инженерии, а также механического или химического разрушения клетки и последующего центрифугирования содержимого.
В дальнейшем для разделения белков по массе, заряду или аффинности используют изоэлектрическое фокусирование, аффинную и другие виды хроматографии. Концентрируют полипептиды высаливанием.
Контроль степени очистки белка проводится с помощью электрофореза, а его идентификация осуществляется методом масс-спектрометрии.
Это далеко не все способы подготовки и изучения полипептидных цепочек. Сейчас также обретают популярность протеомика, предсказание пространственной структуры и её моделирование с помощью компьютерных программ. Все эти сложные методы необходимы для того, чтобы лучше понимать окружающий нас мир и раскрывать больше тайн природы.



Ещё никто не комментировал эту статью. Оставьте комментарий первым!