Формула, химические и физические свойства аммиака
Аммиак — бинарное неорганическое соединение азота и водорода. Степень окисления этих химических элементов -3 и +1 соответственно. Иначе соединение называется нитридом водорода, его формула — NH3. Благодаря набору уникальных физических и химических свойств аммиак занимает одно из первых мест в мире по промышленным объёмам производства.
Оглавление:
Аммиак — бинарное неорганическое соединение азота и водорода. Степень окисления этих химических элементов -3 и +1 соответственно. Иначе соединение называется нитридом водорода, его формула — NH3. Благодаря набору уникальных физических и химических свойств аммиак занимает одно из первых мест в мире по промышленным объёмам производства.
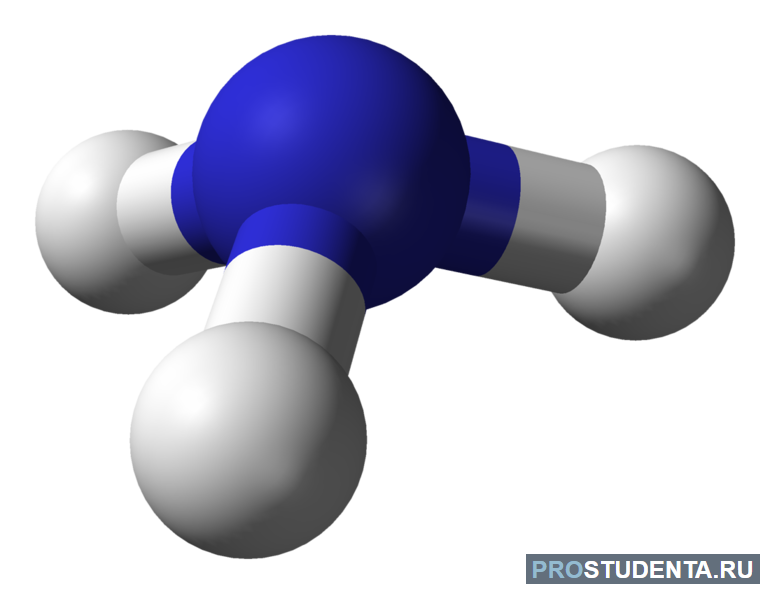
Строение молекулы
Молекула NH3 представляет собой тригональную пирамиду, в которой между атомами азота и водорода образуются три ковалентные полярные связи. Кроме того, четвёртая пара внешних электронов — неподеленная — способна образовывать донорно-акцепторную связь с ионом водорода (ион аммония NH4+).
Для молекул аммиака характерно наличие слабых межмолекулярных водородных связей, обеспечивающих его растворение в воде и относительно простое сжижение газа.
Физические характеристики
В нормальных условиях аммиак — газ без цвета, но с резким специфическим запахом, горючий, пожаро- и взрывоопасный. Его плотность составляет 0,77 кг/ м³, что почти вдвое меньше плотности воздуха, а растворимость в H2O — около 700 объёмов к 1. Из-за этого газообразный реагент нельзя собирать и хранить возле воды.
Аммиак в больших концентрациях опасен для человека: он раздражает слизистые оболочки глаз, органы дыхания и кожные покровы, может вызывать химический ожог роговицы, токсический отёк лёгких и нанести непоправимый урон нервной системе.
Аммиак легко сжижается при повышенном давлении или пониженной температуре (от -33,6 °C). При дальнейшем охлаждении (до -77,8 °C) он превращается в твёрдое вещество белого цвета.
Химические свойства
NH3 характеризуется высокой реакционной способностью. В большинство взаимодействий водный раствор NH3 (NH4OH) вступает как слабое основание и проявляет при этом восстановительные свойства. Химические свойства NH3 проявляются в реакциях:
- С неорганическими кислотами (с образованием средних и кислых солей аммония).
- С органическими кислотами и их производными (ангидридами, галогенангидридами и т. д. . Продуктами реакции являются амиды.
- С альдегидами и кетонами. Продуктами реакции являются N-замещенные имины или основания Шиффа, использующиеся для дальнейшего синтеза аминов.
- С металлами (реагирует в качестве очень слабой кислоты, образуя имиды, амиды и нитриды) и оксидами металлов.
- С галогенами (с образованием опасных взрывчатых веществ).
- Разложения. При повышенной температуре NH3 распадается на простые составляющие, водород и азот, а сгорание в атмосфере кислорода позволяет получить оксид азота.
- Комплексообразования. Молекулы NH3 образуют донорно-акцепторные связи с катионами некоторых металлов (Ag+, Cu2+, Co2+ и т. д. ), что приводит к получению сложных растворимых соединений аммиакатов. Такие аммиачные растворы используются в качестве реагента в качественном анализе.
Атом азота в реакциях способен как изменять степень окисления, так и сохранять её. Результат взаимодействия аммиака с другими химическими соединениями во многом зависит от условий протекания процесса (температуры, концентрации веществ и т. д. ). Примерами типичных реакций аммиака являются:
- 3NH3 + H3PO4 = (NH4)3PO4;
- 2NH3 + 6I2 = 2NI + 6HI;
- CuSO4 + 4NH3 = [Cu (NH3)4] SO4;
- 2NH3 + 2K = 2KNH2 + H2.
Практическое применение
В природе аммиак образуется во время разложения органических азотсодержащих соединений, например, мочевины, содержащейся в продуктах жизнедеятельности животных. Происхождение названия соединения связывают с одним из мест нахождения NH3 в природе — североафриканским оазисом Аммона, где процесс распада, ускоренный повышенной температурой, использовали жрецы-амониане для получения нашатыря.
Сейчас в медицине нашатырный спирт (10% раствор аммиака) применяется при обморочных состояниях пациента и в качестве дезинфицирующего средства. В качестве сырья и расходного материала аммиак применяется:
- для создания удобрений и химических реагентов (уротропина, мочевины и солей аммония);
- при производстве азотной кислоты и соды;
- для получения синтетических волокон (капрона и нейлона), а также в процессе крашения и очистки тканей;
- для нейтрализации кислотных отходов нефтехимической промышленности;
- для упрочнения стали путём насыщения поверхностных слоёв азотом.
Промышленная форма выпуска аммиака — жидкость или водный раствор, содержащий 25% NH3.
В таком виде он используется как дешёвый хладагент или растворитель.





Ещё никто не комментировал эту статью. Оставьте комментарий первым!