Электроотрицательность химических элементов в таблице Менделеева
Сложные химические соединения состоят из различных элементов. В них электронная плотность всегда смещена в направлении более «сильного» соседа. Например, в атоме соляной кислоты таким окажется хлор. Чтобы определять силу атомов, необходимо разобраться с понятием электроотрицательности (ЭО). Эта величина обозначается буквой χ. Определяется электроотрицательность в таблице Менделеева.
Сложные химические соединения состоят из различных элементов. В них электронная плотность всегда смещена в направлении более «сильного» соседа. Например, в атоме соляной кислоты таким окажется хлор. Чтобы определять силу атомов, необходимо разобраться с понятием электроотрицательности (ЭО). Эта величина обозначается буквой χ. Определяется электроотрицательность в таблице Менделеева.
Смысл понятия
Электроотрицательность химических элементов представляет собой способность атома вещества притягивать к себе электроны других атомов в сложных соединениях. Впервые это понятие ввел в начале XX столетия американский химик Лайнус Полинг. Простые элементы можно разделить на две большие группы в соответствии с их химическими и физическими свойствами:
- неметаллы;
- металлы.
Вещества из первой группы могут выступать в роли восстановителя либо окислителя в зависимости от показателя электроотрицательности элемента. Чем он выше, тем активнее вещество проявляет свойства окислителя.
Таким образом, необходимо разобраться с двумя новыми понятиями:
- Окислитель. Это реагент, который во время окислительно-восстановительной реакции принимает электроны.
- Восстановитель. Так называется вещество, которое может отдавать негативно заряженные частицы во время окислительно-восстановительной реакции.
Полингом была составлена специальная шкала электроотрицательности. Максимальной электронегативностию обладает фтор — 4. Минимальный электроотрицательный показатель у франция, и он равен 0,7.
Это вполне логично, ведь франций является металлом и характеризуется способностью отдавать электроны, а не притягивать их.
Способы определения
Чтобы узнать ЭО вещества, можно использовать шкалу Полинга либо таблицу Менделеева. Первый вариант сразу может показаться сложным, но на практике это не так.
Американский ученый расставил все элементы в порядке возрастаниях их электроотрицательности, показатель которой находится в диапазоне 0,7−4. То вещество, у которого этот параметр выше, и является более сильным.
Взглянув на ряд Полинга сразу можно сказать и о том, является конкретное вещество окислителем либо восстановителем. Если элемент обладает электроотрицательностью менее 2, то он проявляет свойства металла и соответственно является восстановителем.
Наиболее мощные восстановительные свойства имеют вещества с электроотрицательностью менее 1. Таким образом, окислительные свойства веществ усиливаются с возрастанием показателя ЭО.
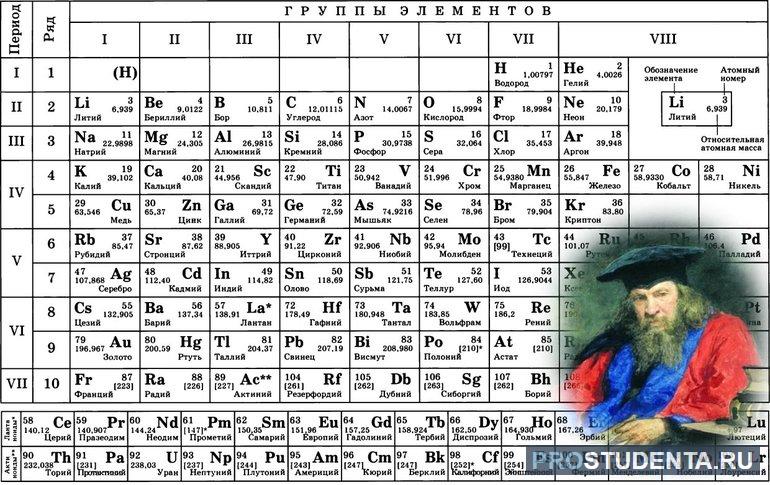
Кроме этого, определить показатель электронегативности любого элемента можно по таблице Менделеева. Для этого необходимо запомнить два правила:
- В периодах с ростом заряда ядра электроотрицательность увеличивается слева направо.
- В группе значение ЭО снижается сверху вниз.
Зная эти правила, можно достаточно просто в любом соединении найти более сильный элемент. Однако химическим элементам нельзя приписывать постоянный показатель ЭО. Эта способность веществ зависит от различных факторов, в том числе от степени окисления и валентности.
Для полного понимания темы предстоит разобраться и с этими понятиями. Степенью валентности называется условный заряд атомов вещества в сложном соединении, определенный на базе предположения, что ионные и ковалентно-полярные соединения состоят исключительно из ионов. Также следует обратить внимание на тот факт, что в соединении суммарная степень окисления атомов равна нулю.
Валентность любого химического элемента определяется числом электронов, принимающих участие в образование химической связи между веществами. В отличие от степени окисления, валентность не имеет знака и не может быть равна нулю. Понятие относительной электроотрицательности (ОЭО) в химии нельзя игнорировать.
Именно с его помощью можно быстрее разобраться с принципами образования химических связей между элементами.
Сложные химические соединения состоят из различных элементов. В них электронная плотность всегда смещена в направлении более «сильного» соседа. Например, в атоме соляной кислоты таким окажется хлор. Чтобы определять силу атомов, необходимо разобраться с понятием электроотрицательности (ЭО). Эта величина обозначается буквой χ. Определяется электроотрицательность в таблице Менделеева.
Сложные химические соединения состоят из различных элементов. В них электронная плотность всегда смещена в направлении более «сильного» соседа. Например, в атоме соляной кислоты таким окажется хлор. Чтобы определять силу атомов, необходимо разобраться с понятием электроотрицательности (ЭО). Эта величина обозначается буквой χ. Определяется электроотрицательность в таблице Менделеева.
Смысл понятия
Электроотрицательность химических элементов представляет собой способность атома вещества притягивать к себе электроны других атомов в сложных соединениях. Впервые это понятие ввел в начале XX столетия американский химик Лайнус Полинг. Простые элементы можно разделить на две большие группы в соответствии с их химическими и физическими свойствами:
- неметаллы;
- металлы.
Вещества из первой группы могут выступать в роли восстановителя либо окислителя в зависимости от показателя электроотрицательности элемента. Чем он выше, тем активнее вещество проявляет свойства окислителя.
Таким образом, необходимо разобраться с двумя новыми понятиями:
- Окислитель. Это реагент, который во время окислительно-восстановительной реакции принимает электроны.
- Восстановитель. Так называется вещество, которое может отдавать негативно заряженные частицы во время окислительно-восстановительной реакции.
Полингом была составлена специальная шкала электроотрицательности. Максимальной электронегативностию обладает фтор — 4. Минимальный электроотрицательный показатель у франция, и он равен 0,7.
Это вполне логично, ведь франций является металлом и характеризуется способностью отдавать электроны, а не притягивать их.
Способы определения
Чтобы узнать ЭО вещества, можно использовать шкалу Полинга либо таблицу Менделеева. Первый вариант сразу может показаться сложным, но на практике это не так.
Американский ученый расставил все элементы в порядке возрастаниях их электроотрицательности, показатель которой находится в диапазоне 0,7−4. То вещество, у которого этот параметр выше, и является более сильным.
Взглянув на ряд Полинга сразу можно сказать и о том, является конкретное вещество окислителем либо восстановителем. Если элемент обладает электроотрицательностью менее 2, то он проявляет свойства металла и соответственно является восстановителем.
Наиболее мощные восстановительные свойства имеют вещества с электроотрицательностью менее 1. Таким образом, окислительные свойства веществ усиливаются с возрастанием показателя ЭО.
Кроме этого, определить показатель электронегативности любого элемента можно по таблице Менделеева. Для этого необходимо запомнить два правила:
- В периодах с ростом заряда ядра электроотрицательность увеличивается слева направо.
- В группе значение ЭО снижается сверху вниз.
Зная эти правила, можно достаточно просто в любом соединении найти более сильный элемент. Однако химическим элементам нельзя приписывать постоянный показатель ЭО. Эта способность веществ зависит от различных факторов, в том числе от степени окисления и валентности.
Для полного понимания темы предстоит разобраться и с этими понятиями. Степенью валентности называется условный заряд атомов вещества в сложном соединении, определенный на базе предположения, что ионные и ковалентно-полярные соединения состоят исключительно из ионов. Также следует обратить внимание на тот факт, что в соединении суммарная степень окисления атомов равна нулю.
Валентность любого химического элемента определяется числом электронов, принимающих участие в образование химической связи между веществами. В отличие от степени окисления, валентность не имеет знака и не может быть равна нулю. Понятие относительной электроотрицательности (ОЭО) в химии нельзя игнорировать.
Именно с его помощью можно быстрее разобраться с принципами образования химических связей между элементами.





Ещё никто не комментировал эту статью. Оставьте комментарий первым!