Электронная конфигурация и строение атома кальция
В науках с физико-математическим уклоном для решения задач иногда необходимо знать атомарную структуру вещества. На уроках химии изучается каждый из элементов периодической системы (таблицы) Дмитрия Ивановича Менделеева и его строение атома. Кальций не является исключением. Однако для начала следует ознакомиться с основными понятиями и положениями о принципах формирования электронной оболочки для различных материалов, определяющей их важные свойства.
Оглавление:
В науках с физико-математическим уклоном для решения задач иногда необходимо знать атомарную структуру вещества. На уроках химии изучается каждый из элементов периодической системы (таблицы) Дмитрия Ивановича Менделеева и его строение атома. Кальций не является исключением. Однако для начала следует ознакомиться с основными понятиями и положениями о принципах формирования электронной оболочки для различных материалов, определяющей их важные свойства.
Общие сведения
Каждый химический элемент состоит из молекул, компонентами которых являются атомы. Последние состоят из следующих структурных единиц:
- Ядра.
- Электроны.
Последние вращаются вокруг ядра по орбитам, которые только отображаются на чертежах (графической схеме). Орбита — условное обозначение расстояния между ядром и электронами, удерживающимися посредством сил кулоновского притяжения. На основании анализа структуры кристаллической решетки ученые открыли некоторые очень важные физико-химические свойства веществ. Например, благодаря изучению строения атома калия, его поместили в ряд щелочных металлов. Он вступает в мгновенную реакцию с водой, образуя щелочь.
Ядро атома
Ядро — основной компонент атома, в котором сосредоточена основная масса. Оно имеет положительный заряд, притягивающий электроны, и состоит из протонов и нейтронов. Протий (легкий изотоп водорода) — единственный химический элемент, не содержащий нейтроны. Если ядро рассматривать в качестве частицы, то химики и физики называют его нуклидом, а нуклоны — совокупность положительно заряженных атомарных единиц.
Количество протонов обозначается литерой «Z», а нейтронов — N. Эти 2 коэффициента, как правило, равны. Однако иногда N превышает или меньше показателя Z. В этом случае говорят, что химический элемент является изотопом или изотоном, т. е. нестандартным. Чтобы их отличать между собой, следует запомнить 2 правила:
- Одинаковое Z и разное N — изотопы.
- Одинаковое N и разное Z — изотоны.
Число «Z» соответствует порядковому номеру в таблице Д. И. Менделеева. Алгебраическая сумма Z и N эквивалентна массовому атомарному числу А, которое также указывается в периодической системе. Оно имеет и другое название — молекулярная масса химического элемента. Кроме того, у ядра существуют и другие характеристики. К основным из них относятся следующие:
- Заряд.
- Масса.
Коэффициент Z определяет уровень электрического заряда. Впервые его открыл ученый Г. Мозли в 1913 году опытным путем, измеряя длину электромагнитной волны водорода. Для других элементов была установлена такая же зависимость от порядкового номера элемента. Заряд протонов, входящих в состав ядра, действует на электроны, которые вращаются вокруг него. Следует отметить, что положительная частица не может притянуть отрицательную, поскольку поле, создающее связь между ними, не способно это сделать.
В некоторых случаях заряд не может удержать электрон. При этом последний «отрывается» с орбитали. В результате такого процесса образуется ион, т. е. атом, который может взаимодействовать с другими.
Структуру строения можно интерпретировать с планетами, вращающимися вокруг Солнца. Последнее не может притянуть их, поскольку недостаточно силы притяжения, которая зависит от расстояния и массы.
Следующей характеристикой ядра является масса. Она измеряется в атомарных единицах массы — а. е. м. Одна «а.е.м.» эквивалентна 1/12 массы атома углерода, который обозначается литерой «С».
Информация об электронах
Электрон — элементарная частица, имеющая отрицательный заряд. Ее масса намного меньше, чем у ядра. У каждой частицы есть своя орбиталь, которая показывает валентность химического элемента. Электроны не только входят в состав атома, но и бывают свободными, т. е. влияют на электрическую проводимость веществ. На основании этого утверждения ученые сделали вывод, что материалы могут классифицироваться на проводники, полупроводники и диэлектрики.
Первые имеют свободные электроны, во вторых они появляются только при воздействии каких-либо внешних сил, способных «вырвать» отрицательно заряженные элементарные частицы с орбитали. В диэлектриках или изоляторах они отсутствуют.
Физико-химические свойства кальция
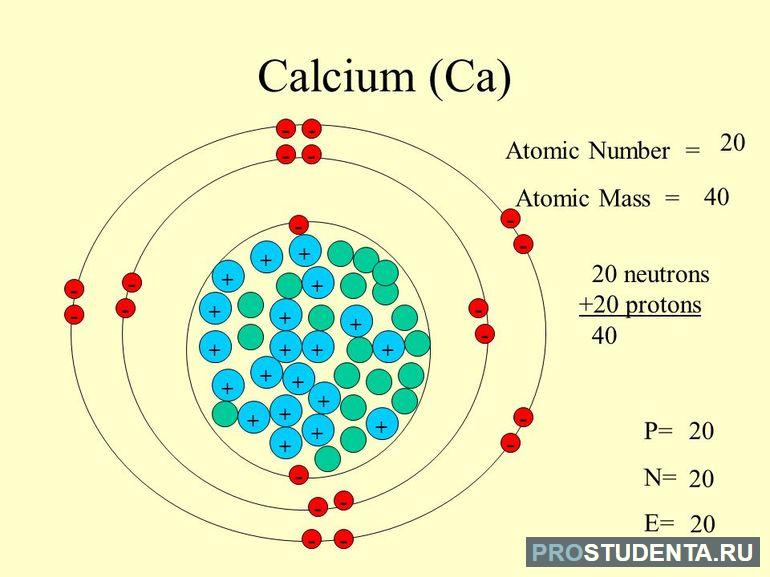
Кальций — химический элемент, относящийся к щелочно-земельным металлам. Он обозначается литерой «Са». В периодической системе находится под порядковым номером «20». Кроме того, обладает атомарной массой, равной 40 а. е. м. (А = 40 а. е. м.). Основным его источником в природе является карбонат кальция или мел, химическая формула которого имеет вид CaCO3.
Температура плавления Са составляет 854 градусов по шкале Цельсия. Под высоким давлением пропускает электрический ток в одном направлении. При взаимодействии с кислородом, входящим в состав атмосферного воздуха, окисляется (Ca2O). Примером окислительной реакции является мел, которые крошится, а при ударе — разбивается на части.
В лабораторных условиях его можно получить при электролизе расплавленного CaCl2. Последнее вещество называется хлоридом кальция. Электролиз — физико-химический процесс, при котором через какое-либо вещество пропускают постоянный ток. В этом случае ионы (заряжены положительно) направляются к электроду (катоду), имеющему отрицательный потенциал (-), а катионы — к положительному (аноду). При этом распад хлорида кальция можно записать в таком виде: ион (Ca2+) и катион (Cl 2 2-).
Схема строения атома и электронная конфигурация кальция определяют его другие химические свойства. Он реагирует с большинством веществ, являющимися сложными и простыми. Сохранить его в чистом виде довольно сложно. Например, чтобы сберечь «чистый» Ca, нужно покрыть его парафином или керосином в емкости без дополнительного доступа кислорода.
Электронная оболочка
Электронная оболочка атома — форма, позволяющая научным путем доказать возможность взаимодействия элемента с другими веществами. Принципы ее образования имеют следующие формулировки:
- Минимум энергии: определяет энергетический обмен между электронами, заполняющими орбитали.
- Паули: на орбитали могут находиться только 2 отрицательно заряженные частицы с противоположными спинами (векторами вращения).
- Хунда: заполнение орбиталей с максимальным количеством электронов с учетом спинов.
Ядро атома имеет положительный заряд «+20», который соответствует порядковому номеру в периодической таблице элементов. Количество Z = 20 и N = 20. Следовательно, вокруг ядра двигаются 20 электронов, поскольку количество положительных нуклонов равняется числу отрицательно заряженных частиц.
Схематически обозначение структуры, состоящей из четырех орбит, имеет такой вид: +20 Ca)2)8)8)2. В этом случае можно записать электронную конфигурацию элемента: 1 s2 2 s2 2 p6 3 s2 3 p6 4 s2. Если сложить показатели степеней подуровней орбит, получается «20», т. е. 2+2+6+2+6+2. Электронная формула заполняется по такому алгоритму:
- Выписывается порядковый номер: 20.
- На первом подуровне должно быть не более 2: 1 s2. Первая орбиталь заполнена.
- Вторая орбита (до 6 на подуровне 2р и 2 на 2s): 2s22p6.
- Третья состоит из двух подуровней, на каждом из которых может находиться 2 и 6 частиц соответственно: 3s2 3 p6 .
- Четвертая также включает 2 подуровня 4s и 4p, но частиц хватает только на 4s: 4 s2.
- Проверка количества электронов: 2+2+6+2+6+2 = 20 (результат соответствует действительности, т. е. равен Z).
На основании электронной конфигурации можно определить еще один параметр Cа, который называется валентностью. Она равна 2, поскольку последняя орбиталь имеет только 2 электрона.
Таким образом, кальций является двухвалентным элементом и обладает физическими и химическими свойствами, которые присущи щелочно-земельным металлам.





Ещё никто не комментировал эту статью. Оставьте комментарий первым!