Характеристика и виды аллотропных модификаций химических элементов
Из одного и того же химического элемента могут состоять несколько простых веществ. Аллотропные модификации — фактически новые соединения, синтезированные из одного элемента. Их наибольшее количество насчитывается у углерода. Последняя модификация была получена летом 2019 года (циклоуглерод).
Оглавление:
Из одного и того же химического элемента могут состоять несколько простых веществ. Аллотропные модификации — фактически новые соединения, синтезированные из одного элемента. Их наибольшее количество насчитывается у углерода. Последняя модификация была получена летом 2019 года (циклоуглерод).
Разновидности модификаций
Сейчас известно более 400 видов соединений, состоящих из атомов одного элемента. Возможность образования аллотропических веществ зависит от особенностей строения атома, определяющих виды химической связи, структуру молекул и кристаллических решеток. Некоторые видоизменения элементов:
- Водород: существует в виде орто- и пара-водорода, у которых векторы импульса атома расположены параллельно.
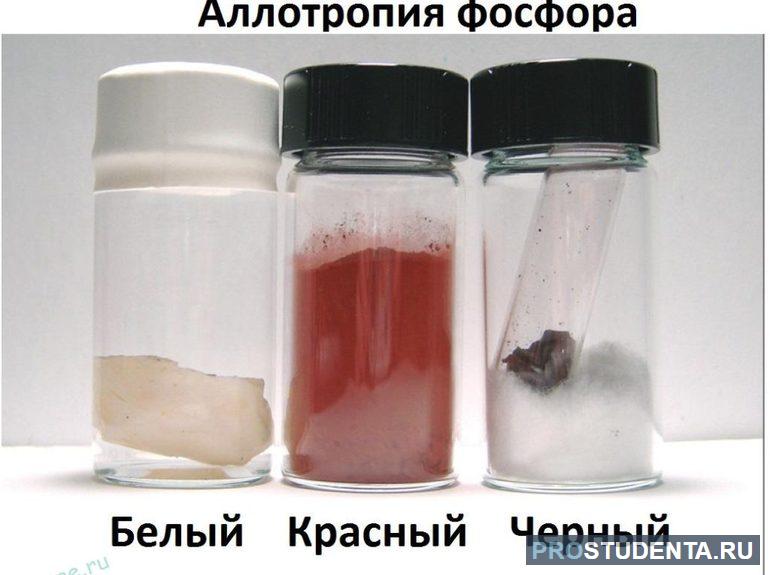
- Фосфор: всего насчитывается 11 модификаций, основные из которых — белый, красный, черный. Ядовитый белый фосфор светится и может воспламеняться, а красный не светится и не горит. Черное вещество отличается инертностью и хорошо проводит электрический ток.
- Кислород (известны два вида аллотропного видоизменения): непосредственно сам кислород и озон.
- Сера: по количеству разновидностей занимает второе место после углерода. Основными модификациями считаются моноклинная, ромбическая и пластическая сера.
- Бор: в химии насчитывается более 10 кристаллизующихся ромбических и тетрагональных видоизменений элемента.
- Олово: существует три аллотропные формулы модификации металла. Серое олово представляет собой порошок из мелких кристаллов и относится к полупроводникам. Белый элемент — мягкий металл серебристого цвета, сохраняющий свойства в диапазоне температур от 13,2 до 161 °C. Гамма-олово имеет ромбическую хрупкую структуру с высокой плотностью.
- Железо: известны четыре видоизменения элемента, которые отличаются друг от друга температурой плавления и структурой кубической решетки.
Все элементы, образующие аллотропные вещества, обладают непостоянными показателями координационного числа или степени окисления. Важна и способность их атомов образовывать разветвленные и неразветвленные цепи. Именно поэтому большей склонностью к аллотропической модификации обладают неметаллы.
Видоизменения углерода
Сейчас насчитывается более 15 аллотропных модификаций углерода. Их молекулярная структура одинакова. Они отличаются строением кристаллической решетки. Например, алмаз обладает кубической структурой, а лонсдейлит (его аналог) — гексагональной.
Таблица. Основные аллотропные модификации углерода.
| Название | Структура | Сравнительная характеристика | Применение |
| Алмаз | Кубическая решетка с неполярной ковалентной связью электронов в атоме | Очень твердый материал | Сверла, резцы, отрезные и шлифовальные круги и т. д. |
| Графит | Вещество состоит из слоев, внутри которых неполярная ковалентная связь, а между ними взаимодействуют молекулы | Обладает электропроводностью и высокой температурой плавления | Электроды, двигатели для ракет-носителей, смазка трущихся деталей |
| Карбин | Прямолинейные цепочки | Полупроводник, обладающий фотоэлектрическими свойствами | Микроэлектроника на моноуглеродной основе |
| Фуллерен | Выпуклые замкнутые многогранники | Твердый, устойчив к химическому воздействию | Литиевые катоды в аккумуляторных батареях, изготовление искусственных алмазов |
Другие модификации углерода — нанотрубки, нанопен, астролены, стеклоуглерод.
Обратимые и необратимые преобразования
Когда вещество обладает возможностью находиться в нескольких формах кристаллических решеток, значит, достигнута определенная температура преобразования. Выше этого показателя устойчивой является одна из модификаций, а ниже — другая.
Если изменить температуру и значение давления, то способные к преобразованию твердые вещества меняют свое строение, но при этом количество элементов остается прежним. На предпосылки видоизменения может указать начало движения элементов кристаллической решетки и перенос небольшой массы вещества. Существует два вида преобразования:
- Энантиотропные (обратимые) — по определению превращения протекают в прямом и обратном направлениях. Температура видоизменения не должна превышать показатели плавления обеих форм.
- Монотропные (необратимые) — видоизменения происходят только в одном направлении.
Когда необходимо получить определенную форму кристаллической решетки, то по специальному методу проводится трехфазная реакция. Для нее следует выбрать оптимальный режим нагрева и его продолжительность для ускорения образования кристаллов.
Если сравнить получение серого олова из белого и преобразование алмаза в графит, то в первом случае процесс будет обратимым, а во втором — монотропным. Эти процессы отличаются технологией проведения.
При энантиотропных преобразованиях чаще всего используется метод снижения температуры сплавов. Сначала происходит временный переход в неустойчивую форму вещества, которая с дальнейшим охлаждением принимает требуемую кристаллическую структуру.
Во время перехода постоянно происходит регулировка давления. Так, для преобразования белого фосфора в черный происходит нагрев до +200 °C, а давление придерживается в районе 1,25 ГПа. При возвращении вещества в нормальные условия обратной модификации не происходит.




Ещё никто не комментировал эту статью. Оставьте комментарий первым!