Конфигурация и формула строения атома алюминия
Первое место среди известных металлов, находящихся в земной коре, занимает тринадцатый элемент в периодической таблице Менделеева — алюминий. Строение атома позволяет элементу обладать высокой электропроводностью и пластичностью. До момента открытия промышленного способа создания вещества оно стоило дороже золота. Из-за высокой сопротивляемости коррозии и низкого веса металл нашёл широкое применение в строительстве, быту, электрике и даже фармацевтике.
Оглавление:
Физические и химические свойства
Процесс получения алюминия несложен. Современный способ разработал американский учёный Чарльз Холл. Что интересно, немного позже этот метод использовал французский химик Поль Эру, незнакомый с исследованиями американца. Суть создания алюминия заключается в растворении оксидированного алюминия в растворе криолита. Затем в жидкость погружают графические электроды. Недостаток метода заключается в больших затратах электроэнергии, поэтому активно он начал использоваться только в начале двадцатого века.
К полезным свойствам алюминия относят его небольшую плотность — она втрое меньше, чем у железа и меди. Материал характеризуется довольно хорошей прочностью, имеет коррозийную стойкость и неплохую теплопроводность. Из-за своих характеристик он нашёл широкое применение как технический материал.
Отсутствие вредных примесей для человеческого организма в веществе, податливость к штамповке и лёгкость позволили применять элемент при изготовлении промышленной и бытовой фольги, кухонной посуды.
В природе алюминий содержится только в минералах.
Его можно извлечь из следующих соединений:
- Гидроокисла — Al2O3 * H20. Бокситы представляют собой глиноподобную массу. Это одна из наиболее важных руд алюминия.
- Алюмосиликата калия и натрия — (Na, K) AlSiO4. Породообразующий материал (элеолит) с шестиугольной кристаллической системой.
- Квасцового камня — KAl3 (SO4)2 (OH)6. Алунит образовывается при воздействии сернокислых вод с силикатами, что создаёт окись алюминия.
- Корунда — Al2O3. Кристаллический глинозём с высокой твёрдостью.
- Силиката — Al2O3. Породообразующий материал, содержащий порядка 19% оксида алюминия в своём составе.
Кроме этого, элемент можно извлечь из каолина, известняка, магнезита. В химических реакция вещество проявляет себя как восстановитель. С галогенами при температуре 20−24 градуса по Цельсию он образовывает галогениды: 2Al + 3Cl2 = 2AlCl3. С другими веществами создаёт бинарные соединения. Например, Al + P = AlP, 4Al + 3C = Al4C3, 2Al+ 3F2 = 2AlF3. При взаимодействии этих соединений с водой образуются гидроксиды и летучие водородные соединения.
С металлами формирует сплавы с интерметаллическими соединениями.
При взаимодействии с кислотами результатом реакции становятся соли. Очищенный алюминий от оксида вступает в активную реакцию с водой: 2Al + 6 H2O = 2 Al (OH)3 + 3H2.
Характеристики элемента
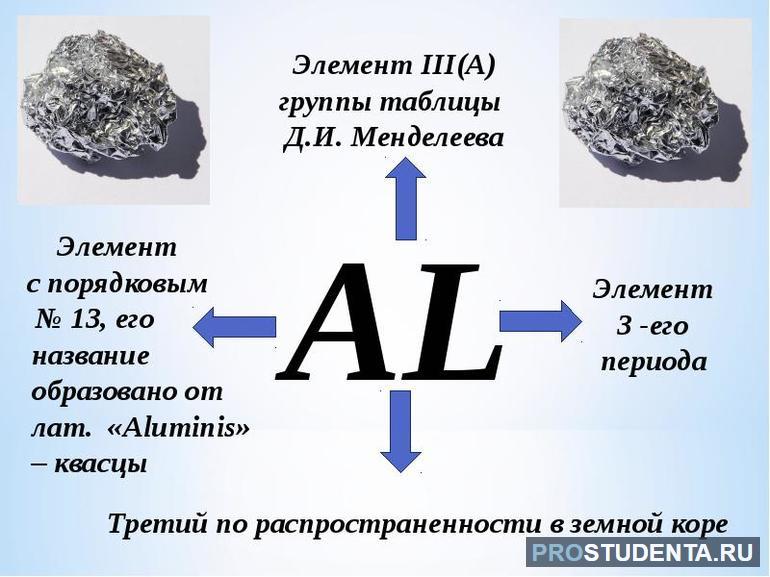
Алюминий — элемент семейства лёгких металлов, уступающий в распространённости только кислороду и кремнию. В периодической таблице он располагается на тринадцатом месте, имеет серебристо-белый цвет. Общепринятое химическое обозначение — Al (от латинского слова aluminium).
Вещество имеет следующие характеристики:
- Относительная атомная масса — 26,981538. Показывает, во сколько раз атом алюминия превышает вес атомной единицы массы, принятой равной 1,67 * 10-27 килограммов.
- Атомный номер — 13. Обозначает число протонов в ядре вещества равное количеству электронов, вращающихся вокруг атома.
- Радиус атома — 143 пикнометра. Определяется расстоянием между ядром и самой удалённой орбитой элемента.
- Ковалентный радиус — 121 пикнометр. Расстояние между ядрами, формирующими ковалентную связь и делённое на 2.
- Электронная формула атома алюминия — 1s 2 2s 2 2p 6 3s 2 3p 1. Число электронов в оболочках в соответствии с энергетическим состоянием.
- Фазовые температуры — при достижении 660 градусов по Цельсию происходит плавление, а при 2518 °C закипание.
- Способность атомов удерживать электроны (электроотрицательность) — 1,61 по Полингу.
- Степень окисления — 3,0. Находится по числу электронов, смещённых от или к атому.
- Плотность — 2,7 г/см3. Отношение массы алюминия к его объёму.
- Молярный объем = 10,0 см3/моль. Определяется отношением объёма вещества к количеству.
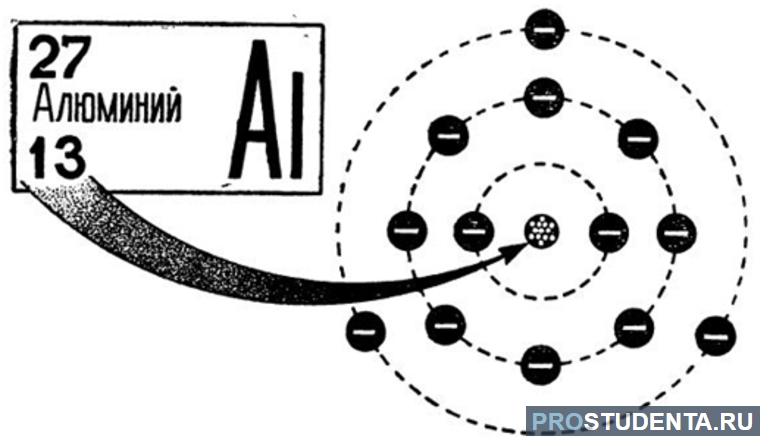
Впервые искусственно алюминий был создан в 1825 году. Получить его сумел датский учёный Эрстед. В ядре вещества содержится 13 протонов и больше на один нейтронов. Всего же массовое число равняется 27. Электроны располагаются на трех энергетических уровнях. На первом размещены 2 электрона, на втором 8 (три пары), а на третьем 3. Такое положение соответствует записи: +13Al)2)8)3.
При этом если атом возбудить, то в этом состоянии все три элемента могут быть отданы, тем самым достигая степени окисления +3 или вызывать образование ковалентных связей. Отсюда следует, что валентность алюминия равняется трём. В природе вещество встречается в глине, слюде, корунде. Взаимодействует со многими элементами, а вот с водородом нет.
При соприкосновении с кислородом образует оксидную плёнку, препятствующую реакциям с водой и азотной и серной кислотой.
Электронная конфигурация
Алюминий можно найти в таблице Менделеева в третьей группе главной подгруппы. Распределение зарядов по орбитали описывается как 1s22s22p63s23p1. Алюминий в периодической таблице имеет тринадцатый номер, так как атом элемента состоит из тринадцати электронов. В электронной конфигурации сумма верхних индексов как раз и составляет это число: 2+2+6+2+1 =13.
Другими словами, верхние индексы показывают количество заряда, распределённого по слоям и орбиталям. Если изобразить схему строения электронной оболочки атома алюминия, можно отметить, что последним заполняемым слоем будет р-орбиталь. А это значит, что вещество принадлежит семейству р-элементов.
Алюминий расположился в третьем периоде. Это значит, что у него 3 электронных слоя. На первом находится s-орбиталь, 3 орбитали расположились на p-слое, и 5 на d-орбитали. На 3d-орбитали пусто, на неё электронов не хватило. На каждом слое не может быть более двух электронов. Заполняются же орбиты, начиная со слоев с меньшей энергией. Теоретически существует возможность возбужденного состояния для атома элемента за счет существования свободной 3d-орбитали. Однако распаривания ионов 3s-подуровня на практике не происходит.
Сначала электроны размещаются в первом слое, потом во втором, а уже затем в третьем. Орбитали каждого слоя заполняются с использованием принципа меньшей энергии. Так, сначала закрывается s-орбиталь, затем каждой орбитали достаётся по одному электрону, а затем по второму. Если их хватает, заполняются оставшиеся внешние р-орбитали.
В атоме алюминия полностью заполняются орбитали первых двух электронных слоев. На первом размещается 2 электрона, а на втором 8 носителей заряда. Два размещаются на s-орбиталь и по 2 на 3 р-орбитали. На третий слой переместятся 3 электрона: 13 — 8 — 2 = 3.
В соответствии с законом сначала до предела зарядами заполняется s-орбиталь третьего слоя, а на три р-орбитали хватает только 4 электрона. Из них 3 элементарные частицы занимают свою орбиталь, а после одна из р-орбиталей приобретает парный электрон.
Составление строения
На уроках химии в седьмом классе ученикам показывают, как графически изображают электронные формулы различных элементов. При составлении конфигураций учитывают правила Паули и Клечковского (Хунда). Модель записывается для атомов, находящихся в возбуждённом состоянии. При составлении учитывают, что порядковый номер периода элемента определяет количество энергетических оболочек, а порядок — число носителей заряда.
Беря во внимание, что согласно правилу Клечковского, энергетические уровни заполняются в соответствии с порядком возрастания главного и орбитального квантового числа, используют формулу n + 1. Так, действует следующее правило: 1 s < 2 s < 2 p < 3 s < 3 p < 4 s ≈ 3 d < 4 p < 5 s ≈ 4 d < 5 p < 6 s ≈ 5 d ≈ 4 f < 6 p. Перемещение атомов происходит согласно запретному принципу. Сформулировал его Паули. Он утверждал, что на одной орбитали могут разместиться только 2 иона, отличные квантовым числом спина.
Из его утверждения следует, что количество электронов на энергетических уровнях соответствует квадрату главного квантового числа, умноженному на 2. Форма обозначения подразумевает, что главное квантовое число обозначают арабской цифрой. Затем записывают букву, определяющую энергетический подуровень, характеризующий орбитальное квантовое число. Верхний индекс указывает на число электронов, формирующих подуровень.
При заполнении энергетических подуровней следует придерживаться правила Хунда. В соответствии с ним, частицы стремятся достигнуть наибольшего суммарного спина. Для валентных ионов алюминия электронно-графическая формула изображается с использованием квадратов и стрелок. Ячейки обозначают орбитали, а стрелки — спины. В одном квадрате не может быть больше двух электронов.
На первом уровне (s) для алюминия рисуют один квадрат с двумя стрелками. На втором (p) нужно изобразить 4 квадрата с заполненными стрелками.
На заполнение третьего уровня остаётся только 3 электрона, поэтому на последнем уровне (d), будет нарисовано только 2 квадрата, при этом во второй помещена только одна стрелка.






Ещё никто не комментировал эту статью. Оставьте комментарий первым!