Химические свойства спиртов
Химические свойства спиртов это их реакции при взаимодействии с другими соединениями, обусловленные гидроксилами.
Оглавление:
Они почти нейтральны: не меняют цвет индикаторов, не реагируют ни с разбавленными кислотами, ни с щелочными и водными растворами.
Но в определённых реакциях демонстрируют свойства очень слабых оснований и кислот.
Классификация спиртов
Атомность определяется так:
- В молекуле одноатомного спирта имеется одна гидроксогруппа: СН3 – СН2 – СН2ОН (пропанол С3Н7ОН).
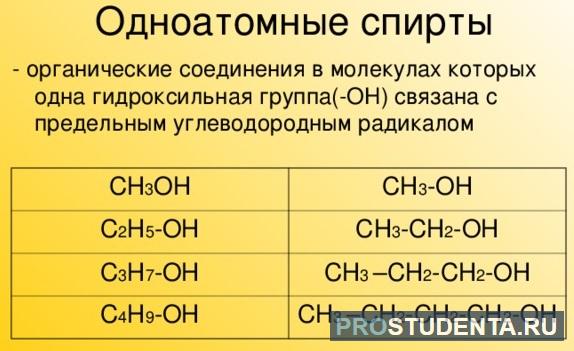
- В молекуле многоатомного спирта имеется две либо более гидроксилы: СН2ОН — СН2 - СН2ОН.

Спирты классифицируются по трём характеристикам:
- Количество гидроксилов:
- одноатомные (этанол С₂H₅OH, СH₃СH₂OH);
- двухатомные (этиленгликоль C₂H₆O₂, C₂H₄(OH)₂);
- многоатомные (глицерол C3H5(OH)3);
- Характер углеводородного радикала:
- непредельные — производные непредельных углеводородов, атом водорода в молекулах которых замещается на гидроксогруппу: аллиловый спирт Н2С = СН — СН2 — ОН;
- предельные — производные предельных углеводородов, у которых один или больше водородных атомов замещаются на гидроксогруппу. Формула: R — ОН, где R — радикал: CH3 — CH2 - OH (этанол);
- ароматические включают OH в боковой цепочке (бензиловый спирт);
- Характер атома углерода, имеющего связь с гидроксогруппой:
- первичные - гидроксогруппа расположена у атома углерода, имеющего связь лишь с ещё одним его атомом (пример: R — CH2 - OH (этанол));
- вторичные - гидроксоруппа располагается у атома углерода, который связан лишь с двумя соседними его атомами (пример: R — СН(ОН) - R’ (пропанол – 2));
- третичные - гидроксогруппа расположена у атома углерода, связанного с тремя соседними его атомами (пример: R’’ - C - OH (2-метилпропанол-2)).
Изомерия
Понятие «изомерия» ввёл в химию Й. Берцелиус в 1830 г., а истинное обоснование было дано во 2 половине 19 века.
Изомерия — факт наличия химсоединений — изомеров, обладающих идентичной молекулярной массой и составом, но отличных по нахождению или строению атомов и по свойствам.
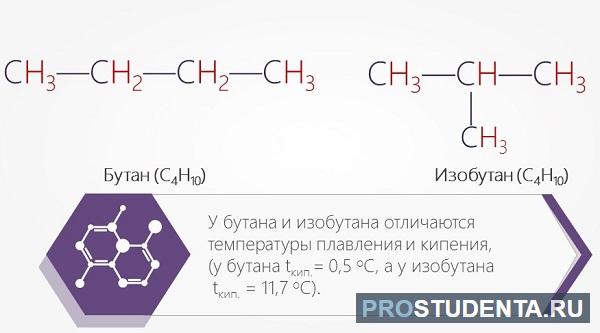
Так, формула бутана – С4Н10. Бутан, в молекуле которого углеродные атомы располагаются в форме линейной цепи, называют обычным, а бутан, цепь атомов которого имеет разветвлённую структуру, дают название изобутан.
Для предельных одноатомарных спиртов характерны три вида изомерии:
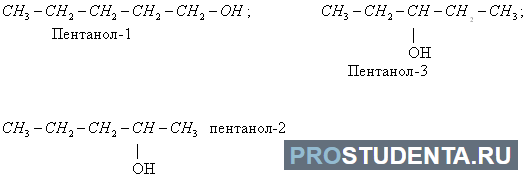
- изомерия расположения функциональных групп и двойной связи:
- изомерия углеродного скелета:
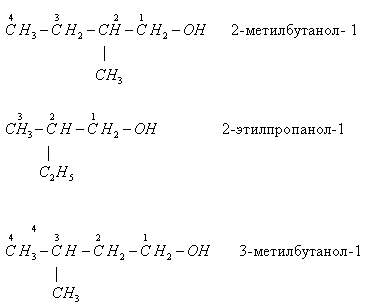
- межклассовая:
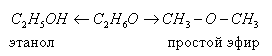
Номенклатура
Как образуется название спирта?
Наименование спирта = наименование углеводорода + префикс + -ОЛ + (n1, n2..., nn), означающий количество гидроксил в молекуле: 2 – «ди», 3 – «три», 4 – «тетра» и т. д.

Присваивание номера атомам углерода начинается с окончания, ближайшего к гидроксогруппе.
Буква n сообщает расположение гидроксогрупп в цепочке углеродов.
Насыщенные одноатомарные спирты формируют гомологический ряд. Структурная формула алканолов: CnH2n +1 OH. Открывает ряд метанол CH3OH. Далее идёт этанол C2H5OH. Затем – пропанол C3H7OH, бутанол C4H9OH и т. д.
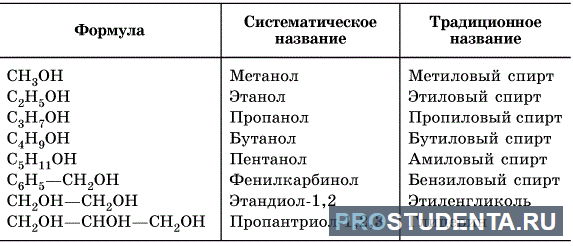
Физические свойства спиртов
Краткая характеристика следующая:
- Температура кипения и плавления, как и углеводородных соединений, увеличивается с повышением количества атомов углеродов в молекуле, но показатели значительно больше, нежели у углеводородов.
- Растворяются в воде намного лучше углеводородов. С повышением количества атомов углерода проявляется гидрофобный эффект, то есть растворимость в воде снижается. А при R, включающем более 9 углеродных атомов, почти пропадает. Данные о растворимости кратко приведены в таблице.
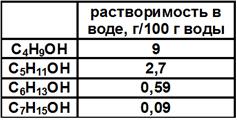
Причина – сильная полярность, формирование H-связей между молекулами воды и спиртами;
[warning]Это интересно: низшим спиртам свойственен специфический аромат. Так, запах кошки возникает из-за того, что его главным элементом служит изопропанол.[/warning]
Химические свойства
Спиртам присущи следующие особенности:
- Реакции дегидрирования. Внутримолекулярное дегидрирование с формированием алкенов проходит во взаимодействии с концентрированной Н2SO4 при нагреве более 140°С:
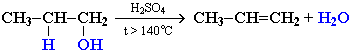
Межмолекулярное дегидрирование идёт при температуре меньше 140°С с формированием простых эфиров: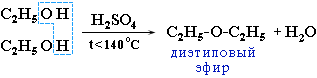
- Формирование галоидных алкилов (галогенирование) проходит при реагировании с разными агентами:
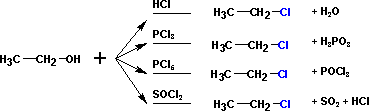
Всегда лучше проходят взаимодействия с первичными спиртами, третичные зачастую вызывают разнообразные побочные продукты;
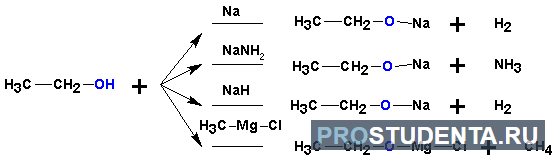
- Кислотные свойства — способность отщеплять За счёт этого они способны реагировать с металлами и щёлочами:
- Окисление проходит до кетонов и альдегидов с помощью разных окислителей;
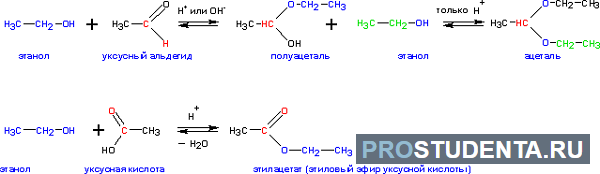
- Формирование сложных эфиров, образующихся при реакции с минеральными и органическими кислотами при умеренном нагреве:
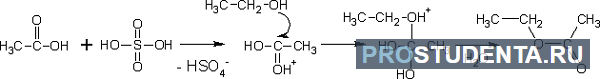
- Формирование ацеталей и кеталей при реагировании с кетонами и альдегидами соответственно:
Способы получения

Итак, как же получают спирты:
- Многоатомарные спирты формируются при гидролизе алкилгалогенидов, в которых присутствует в одной молекуле больше одного атома галогена.
- H присоединяется к молекулам альдегидов в группе С = О по двойной связи. Результатом первого процесса будут первичные спирты. Гидрирование кетонов формирует вторичные.
- Гликоли получают путём окисления алкенов водяным раствором марганцовки.
- Брожение глюкозы. Данный метод получать алкоголь осуществляется с древних времён.
- Гидратация алкенов, при которой вода присоединяет по тг-связи молекулы.
- Специфичные методы. Так, метанол выделяется при реагировании H с окисью углерода (II) при большой температуре и увеличенном давлении с участием катализатора (окиси цинка).
Применение спиртов
Участие спиртов во множестве реакций даёт возможность получать многообразные органические соединения, используемые как растворители при изготовлении красящих веществ, лекарств, медицинского спирта и полимеров.
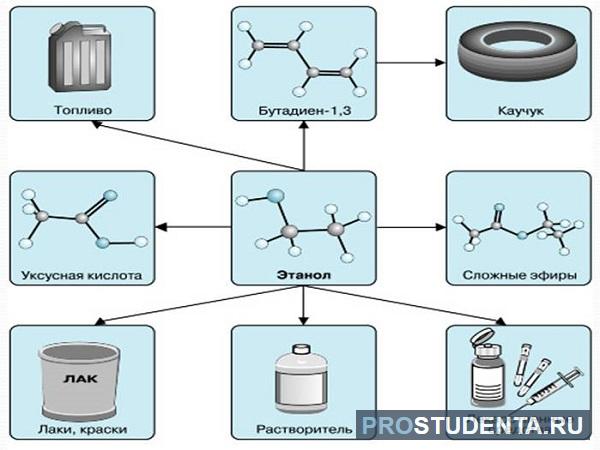
Бутанол С4Н10О может использоваться в топливных элементах, как сырьё для производства водорода.
Искусственные высшие жирные спирты (гексиловый спирт C6H13OH) добываются с помощью органического синтеза и помимо природных высших жирных спиртов (жиров, восков и масел), применяются для получения флотореагентов, растворителей, пластификаторов, ароматических жидкостей.
Заключение
Спирт – органическое соединение, имеющее многообразный и широчайший класс. Получать его разнообразные виды возможно не только в лабораториях, но и из естественной среды. Кроме того, некоторые витамины относятся к спиртам, например, А, В8 и D.


Ещё никто не комментировал эту статью. Оставьте комментарий первым!