Электролитическая диссоциация: сущность теории С. Аррениуса
 Своё начало теория электролитов берёт ещё в первой половине XIX века, когда М. Фарадей провёл свои знаменитые опыты с растворами поваренной соли. Он установил, что абсолютно чистая вода очень плохо проводит электрический ток, но стоит добавить в неё несколько кристаллов соли, и проводимость тут же возрастает. Уже тогда родилось предположение, что соль распадается в воде на некие частицы, которые способны проводить электрический ток, однако, полноценная теория, описывающая все эти процессы в растворах, появилась гораздо позже.
Своё начало теория электролитов берёт ещё в первой половине XIX века, когда М. Фарадей провёл свои знаменитые опыты с растворами поваренной соли. Он установил, что абсолютно чистая вода очень плохо проводит электрический ток, но стоит добавить в неё несколько кристаллов соли, и проводимость тут же возрастает. Уже тогда родилось предположение, что соль распадается в воде на некие частицы, которые способны проводить электрический ток, однако, полноценная теория, описывающая все эти процессы в растворах, появилась гораздо позже.
Оглавление:
Теория электролитической диссоциации
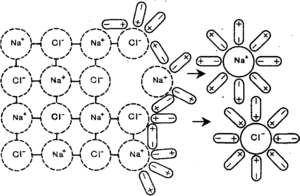
 Теория, основоположником которой явился Сванте Аррениус в период 1883—1887 гг., базируется на идее, что при попадании молекул растворимого вещества (электролита) в полярную или неполярную жидкость происходит их диссоциация на ионы. Электролитами называются соединения, которые в растворе самопроизвольно распадаются на ионы, способные к самостоятельному существованию. Количество образующихся ионов, их строение и величина заряда зависят только от природы диссоциировавшей молекулы.
Теория, основоположником которой явился Сванте Аррениус в период 1883—1887 гг., базируется на идее, что при попадании молекул растворимого вещества (электролита) в полярную или неполярную жидкость происходит их диссоциация на ионы. Электролитами называются соединения, которые в растворе самопроизвольно распадаются на ионы, способные к самостоятельному существованию. Количество образующихся ионов, их строение и величина заряда зависят только от природы диссоциировавшей молекулы.
 Для использования теории в описании свойств растворения используется ряд допущений, а именно: предполагается, что диссоциация является неполной, ионы (их электронные оболочки) не реагируют друг с другом, а их поведение можно описать законом действующих масс в идеальных условиях. Если рассмотреть теоретическую систему, где электролит КА находится в фазовом равновесии с продуктами своей диссоциации — катионом К+ и анионом А-, то согласно закону действующих масс можно составить уравнение реакции диссоциации:
Для использования теории в описании свойств растворения используется ряд допущений, а именно: предполагается, что диссоциация является неполной, ионы (их электронные оболочки) не реагируют друг с другом, а их поведение можно описать законом действующих масс в идеальных условиях. Если рассмотреть теоретическую систему, где электролит КА находится в фазовом равновесии с продуктами своей диссоциации — катионом К+ и анионом А-, то согласно закону действующих масс можно составить уравнение реакции диссоциации:
KA = K+ + A- (1)
Константа равновесия, записанная, через концентрации веществ при изотермических условиях будет иметь следующее значение:
Кд = [K+] x [A-] / [KA] (2)
 В этом случае (в уравнении 2), константа равновесия Кд, будет являться не чем иным, как константой диссоциации, значения [KA], [K+], [A-] в правой части — это равновесные концентрации электролита и его продуктов диссоциации.
В этом случае (в уравнении 2), константа равновесия Кд, будет являться не чем иным, как константой диссоциации, значения [KA], [K+], [A-] в правой части — это равновесные концентрации электролита и его продуктов диссоциации.
Учитывая допущение теории Аррениуса, которые были применены автором, в частности, о неполноте диссоциации, вводится понятие степени диссоциации — α. Таким образом, если выразить концентрацию раствора С (моль/л), то на литр раствора приходится αС моль электролита (КА), а равновесная его концентрация может быть выражена, как (1-α)С моль/л. Из уравнения реакции (1) очевидно, что на αС моль электролита (КА) образуется такое же количество ионов К+ и А-. Если подставить все эти величины в уравнение (2) и провести ряд упрощений, то получим формулу константы диссоциации (степень диссоциации формула):
Кд = ∝ 2 x С /1-∝ (3)
 Это уравнение позволяет количественно определить величину степени электролитической диссоциации в разных растворах.
Это уравнение позволяет количественно определить величину степени электролитической диссоциации в разных растворах.
Теория Аррениуса дала развитие множеству научных направлений в химии: с её помощью были созданы первые теории кислот и оснований, были даны объяснения физико-химическим процессам в гомогенных системах. Тем не менее, она не лишена недостатков, которые в основном относятся к тому факту, что теория не учитывает межионные взаимодействия.
Классификация электролитов с примерами
Электролиты классифицируют на слабые и сильные, периодически выделяя группу электролитов средней силы. Сильные электролиты характеризуются тем, что распадаются в растворе полностью. Как правило — это сильные минеральные кислоты, например:
- Азотная кислота — HNO3.
- Хлороводородная кислота — HCl.
- Хлорная кислота — HClO4.
- Ортофосфорная кислота — H3PO4.
Сильными электролитами могут быть основания, например:
- Гидроксид натрия — NaOH.
- Гидроксид калия — KOH.
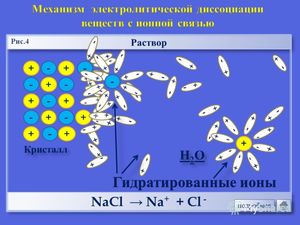
 Основная масса сильных электролитов — это подавляющее большинство солей (NaCl, Na2SO4, Ca (NO3)2, CH3COONa, хлориды, сульфиды).
Основная масса сильных электролитов — это подавляющее большинство солей (NaCl, Na2SO4, Ca (NO3)2, CH3COONa, хлориды, сульфиды).
Слабые электролиты, напротив, в растворах гидратируют частично. К этой группе следует относить неорганические кислоты (H2CO3, H3BO3, H3AsO4), слабые основания (аммоний), некоторые соли (HgCl2), органические кислоты (CH3COOH, C6H5COOH), фенолы и амины. В неводных растворах одни и те же соединения могут являться и сильными и слабыми электролитами, таким образом, зависят от природы растворителя.
Диссоциация кислот, оснований и солей
Закономерности для кислот
При электрической диссоциации кислот в водных растворах обязательно в качестве катионов образуются положительно заряженные ионы водорода (Н+):
HBr→ H+ + Br-
HNO3 → H+ + NO3-
Если кислота многоосновная (например: уравнение диссоциации H2SO4), то диссоциация происходит последовательно, за каждый раз отщепляя один ион водорода:
H2SO4 → H + + HSO4- первая ступень — гидросульфат ион
HSO4- → H + + SO4- вторая ступень — сульфат ион
Процесс для многоосновной кислоты, как правило, протекает максимально по первой ступени, степень диссоциации последующих намного меньше.
Характеристика процесса для щелочей
При диссоциации щелочей в водных растворах обязательно образуется отрицательно заряженный гидроксил ион (ОН-):
NaOH → Na+ + OH-
Процесс для многокислотных оснований (пример — механизм диссоциации гидроксида магния) протекает многоступенчато аналогично многоосновным кислотам:
Mg (OH)2 → OH- + Mg (OH)+ первая ступень
Mg (OH)+ → OH- + Mg2+ вторая ступень
Существуют также случаи, когда в процессе диссоциации могут образовываться и катионы водорода, и гидроксил-анионы (при диссоциации амфолитов или амфотерных соединений, например, Zn, Al):
2OH- + Zn2+ + 2H2O ←→ Zn (OH)2 + H2O ←→ [Zn (OH)4]2- + 2H+
Правила протекания для кислых и основных солей
Для кислых солей, основная закономерность заключается в следующем — сначала диссоциируют катионы (положительно заряженные металлы), а только потом катионы водорода:
KHSO4 → K+ + HSO4- первая ступень
HSO4 — → H+ + SO4- вторая ступень
У основных солей, в первую очередь, переходят в раствор остатки кислоты, а уже затем гидроксил-ион:
BaOHCl → Cl- + Ba (OH)+ первая ступень
Ba (OH)+ → OH- + Ba2+ вторая ступень
Водородный показатель
Определение, сущность и значение
Процессы диссоциации могут протекать не только для растворенных веществ, но и растворителя. Так, вода является сама со себе слабым электролитом и для неё характерна диссоциация в очень незначительной степени. Уравнение процесса можно записать следующим образом:
Н2О= Н3О+ + ОН-
Одна молекула воды диссоциирует на положительно заряженные ионы водорода и отрицательно заряженные анионы гидроксония. Именно концентрация этих ионов определяет уровень кислотности раствора — чем больше ионов гидроксония, тем более кислый раствор.
Концентрация ионов гидроксония в реальных растворах, как правило, очень мала (например: 5×10−6 г/л) и поэтому для удобства, это значение логарифмируют, а чтобы получить положительное значение, берут с обратным знаком. Кратко сформулируем строгое определение понятия «водородный показатель» или рН.
рН (водородный показатель) — это отрицательный натуральный логарифм концентрации ионов гидроксония, отражающий кислотность раствора.
рН= - lg [H3O+]
Значения водородного показателя принято оценивать по шкале значений от 0 до 14, где 0 — наиболее кислый раствор, а 14 — наиболее щелочной. Нейтральным раствором (соответствующим рН чистой воды) считается раствор со значением 7. Для примера приводим несколько типичных растворов, имеющих характерные значения водородного показателя:
| Значение рН | Раствор |
| 11 | Нашатырный спирт |
| 9,5 | Гидроксид кальция |
| 8,0 | 30% раствор поваренной соли |
| 7,4 | Плазма крови |
| 7,0 | Деионизированная вода |
| 6,5 | Молоко |
| 5,5 | Кофе |
| 2,8 | Уксус (раствор 5% концентрации) |
| 0,1 | Хлорная кислота (65%) |
Значительно реже прибегают к использованию еще одного показателя — рОН. По своему смыслу он абсолютно аналогичен водородному показателю, за исключением того, что за основу берётся концентрация гидроксил-ионов.


Ещё никто не комментировал эту статью. Оставьте комментарий первым!